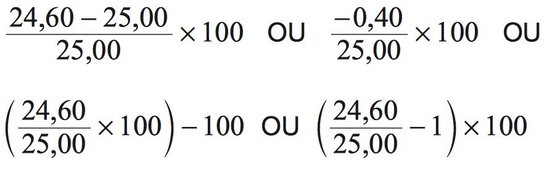FÍSICA E QUÍMICA 11º ANO
A correção da Prova Final de Física e Química do 11º ano do Ensino Secundário está disponível no site do IAVE. Para consultar o enunciado clique aqui. Para ter acesso aos critérios de avaliação completos siga para este site.
Grupo I
| Nº | Versão 1 | Versão 2 | Pontuação |
| 1 | (D) | (C) | 5 |
| 2 | -100 J (ou equivalente). OU [A energia interna do sistema] diminuiu 100 J. |
5 | |
| 3 | 15 no total | ||
| Determinação da energia necessária para aumentar a temperatura da massa de gelo considerada de -10,0 oC para 0,0 oC (E = 8,440 × 103 J) | 5 | ||
| Determinação da energia que sobra para a fusão do gelo (E = 8,356 × 104 J) | 4 | ||
| Determinação da massa de gelo que se fundiu (m = 0,2502 kg) | 4 | ||
| Determinação da massa de gelo que não se fundiu (m = 0,150 kg) | 2 | ||
| 4 | (C) | (A) | 2 |
Grupo II
| Nº | Versão 1 | Versão 2 | Pontuação |
| 1.1 | (A) | (D) | 5 |
| 1.2 | (A) | (B) | 5 |
| 2.1 | 10 no total | ||
|
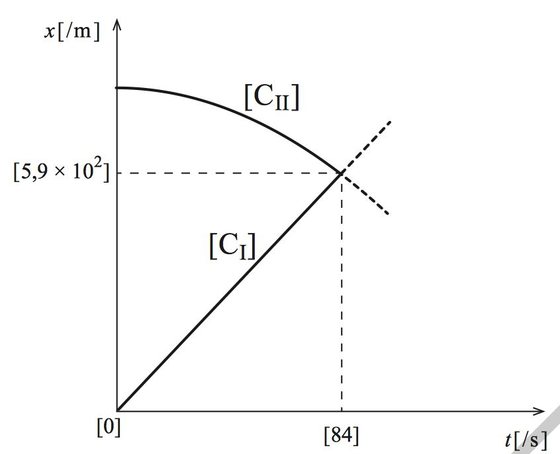
Apresentação dos esboços dos gráficos que traduzem as componentes escalares das posições, xCI e xCII, dos conjuntos CI e CII, respetivamente, em função do tempo, desde o instante t = 0s até, pelo menos, ao instante em que os conjuntos se cruzam |
4 | ||
| Determinação do instante em que os conjuntos CI e CII se cruzam (t = 84 s) | 3 | ||
| Determinação da componente escalar da posição dos conjuntos no instante em que se cruzam (x = 5,9 × 102 m) | 3 | ||
| 2.2 | (D) | (B) | 5 |
| 2.3 | (C) | (D) | 5 |
| 3 | 15 no total | ||
| Determinação da energia mecânica do sistema quando o conjunto ciclista + bicicleta atinge a altura de 3,0 m (Em = 2,89 × 103 J) OU Determinação da variação da energia cinética do conjunto ciclista + bicicleta e da variação da energia potencial gravítica do sistema, no percurso considerado (DEc = –1,51 × 103 J e DEp = 2,40 × 103 J) |
5 | ||
| Determinação da variação da energia mecânica do sistema, no percurso considerado (DEm = 8,90 × 102 J) | 4 | ||
| Determinação da intensidade da resultante das forças não conservativas que atuam no conjunto ciclista + bicicleta, na direção do deslocamento (F = 13 N) | 6 | ||
| OU | |||
| Determinação do módulo da aceleração do conjunto, no percurso considerado (a = 0,277 m s-2) | 5 | ||
| Determinação da intensidade da resultante das forças que atuam no conjunto ciclista + bicicleta (F = 22,2 N) | 4 | ||
| Determinação da intensidade da componente tangencial da força gravítica que atua no conjunto ( Fg t = 35,3 N ) e determinação da intensidade da resultante das forças não conservativas que atuam no conjunto ciclista + bicicleta, na direção do deslocamento (F = 13 N) | 6 | ||
Grupo III
| Nº | Versão 1 | Versão 2 | Pontuação |
| 1.1 | (B) | (C) | 5 |
| 1.2 | (D) | (C) | 5 |
| 2 | (D) | (B) | 5 |
| 3 | 10 | ||
| A resposta integra os dois tópicos de referência com organização coerente dos conteúdos e linguagem científica adequada. | 10 | ||
| A resposta integra os dois tópicos de referência com falhas na organização dos conteúdos ou na utilização da linguagem científica. | 8 | ||
| A resposta integra apenas um dos tópicos de referência com linguagem científica adequada. | 5 | ||
| A resposta integra apenas um dos tópicos de referência com falhas na utilização da linguagem científica. | 3 | ||
| R. | Quando um sinal sonoro atinge a membrana do microfone, esta vibra, provocando uma oscilação da bobina em relação ao íman [fixo]. Esta oscilação provoca uma variação do fluxo magnético que atravessa a bobina, induzindo nesta uma força eletromotriz que é responsável pelo aparecimento de um sinal elétrico. | ||
Grupo IV
| Nº | Versão 1 | Versão 2 | Pontuação |
| 1.1 | (C) | (A) | 5 |
| 1.2 | (D) | (C) | 5 |
| 1.3 | (B) | (A) | 5 |
| 1.4 | Cl+ | 5 | |
| 2.1 | 6,02 × 1022 átomos (ou equivalente) | 5 | |
| 2.2 | 10 no total | ||
| Cálculo da massa da mistura gasosa (m = 7,572g) | 4 | ||
| Cálculo do volume da mistura gasosa, nas condições de pressão e de temperatura consideradas (V = 2,912 dm3) | 3 | ||
| Cálculo da densidade da mistura gasosa, nas condições de pressão e de temperatura consideradas ( t = 2,60 g dm-3 ) | 4 | ||
| 3.1 | Oito [eletrões] OU quatro pares [de eletrões]. | 5 | |
| 3.2 | (B) | (D) | 5 |
Grupo V
| Nº | Versão 1 | Versão 2 | Pontuação |
| 1 | (B) | (D) | 5 |
| 2.1 | 10 no total | ||
| Determinação da quantidade de I2(g) que reagiu (n = 1,100 × 10-3 mol) | 3 | ||
| Determinação da quantidade de HI(g) que se terá formado (n = 2,200 × 10-3 mol ) | 2 | ||
| Determinação da concentração de equilíbrio de H2(g) , a 763 K ([H2] = 7,21 × 10-5 mol dm-3) | 3 | ||
| Determinação da quantidade de H2(g) que deverá existir no reator (n = 7,2 × 10-5 mol) | 2 | ||
| 2.2 | 10 no total | ||
| A resposta integra os três tópicos de referência com organização coerente dos conteúdos e linguagem científica adequada. | 10 | ||
| A resposta integra os três tópicos de referência com falhas na organização dos conteúdos ou na utilização da linguagem científica. | 8 | ||
| A resposta integra apenas os tópicos de referência A e B ou apenas os tópicos de referência B e C com organização coerente dos conteúdos e linguagem científica adequada. | 6 | ||
| A resposta integra apenas os tópicos de referência A e B ou apenas os tópicos de referência B e C com falhas na organização dos conteúdos ou na utilização da linguagem científica. OUA resposta integra apenas o tópico de referência A ou apenas o tópico de referência B com linguagem científica adequada. |
4 | ||
| R. |
A constante de equilíbrio da reação diminui à medida que a temperatura aumenta, o que significa que o aumento de temperatura favorece a reação inversa. Como [, de acordo com o Princípio de Le Châtelier,] um aumento de temperatura favorece a reação endotérmica, conclui-se que a reação direta é exotérmica. Assim [, para a reação considerada,] a energia absorvida na quebra das ligações será menor do que a energia libertada no estabelecimento das ligações. |
||