Última atualização às 18h00
O prémio Nobel da Química 2017 foi atribuído a Jacques Dubochet, investigador na Universidade de Lausanne (Suíça), Joachim Frank, investigador da Universidade Columbia (Nova Iorque) e Richard Henderson, investigador do Laboratório de Biologia Molecular do Conselho de Investigação Médica (Cambridge, Reino Unido), pelos desenvolvimentos na microscopia crioeletrónica, uma técnica que permite ver estruturas de biomoléculas em solução.
BREAKING NEWS The 2017 #NobelPrize in Chemistry is awarded to Jacques Dubochet, Joachim Frank & Richard Henderson. pic.twitter.com/RUZSnArJHO
— The Nobel Prize (@NobelPrize) October 4, 2017
Durante muito tempo os microscópios eletrónicos eram usados exclusivamente para observar matéria morta, porque o feixe de eletrões destruía qualquer forma de vida. Em 1990, Richard Henderson contrariou essa ideia e usou o microscópio eletrónico para ver, ao nível do átomo, a estrutura tridimensional de uma proteína.
Usar água num microscópio eletrónico é impossível, porque a água evapora no vácuo e faz colapsar as biomoléculas. Jacques Dubochet conseguiu, no início dos anos 1980, vitrificar a água — arrefecê-la muito rapidamente — permitindo que as biomoléculas mantivessem a forma natural mesmo no vácuo.
O trabalho de Joachim Frank não foi menos importante. Entre 1975 e 1986 desenvolveu um método que permitia agrupar as imagens bidimensionais do microscópio em imagens tridimensionais com maior resolução. É a combinação do trabalho destes três investigadores que está na base da microscopia crioeletrónica.
Prémio Nobel da Química para a capacidade do microscópio óptico ver partículas ainda mais pequenas
Já em 2014, o prémio Nobel da Química tinha sido atribuído a uma técnica de microscopia, neste caso microscopia ótica, mas também pelo aumento da resolução. A ideia para os dois prémios é a mesma: ver estruturas cada vez mais pequenas.
O prémio tem o valor de nove milhões de coroas suecas (cerca de 937 mil euros) que será distribuído pelos três laureados.
Ver cada vez mais pequeno
Temos um fascínio por coisas muito distantes, como os buracos negros que colidem a muitos milhões de anos-luz da Terra, ou por estruturas muito, muito, mas mesmo muito pequenas. E os prémios Nobel da Física e da Química 2017 refletem isso mesmo. Com a técnica de microscopia crioeletrónica é possível acrescentar melhorias às técnicas microscopia eletrónica e cristalografia de raios X já de si de alta resolução.
Os microscópios eletrónicos existem há muito tempo e têm permitido ver estruturas cada vez mais pequenas, mas têm uma desvantagem: o feixe de eletrões é tão intenso que acaba por destruir as estruturas biológicas. A microscopia crioeletrónica usa feixes muito menos intensos, para não destruir as amostras em estudo, mas também não permite ver tão claramente.
“Se tem uma lâmpada numa sala quanto mais intensa for a luz melhor consegue ver. Agora imagine que a luz é tão intensa que acaba por queimar a folha que estava a tentar ler”, diz ao Observador Pedro Matias, investigador no Instituto de Tecnologia Química e Biológica (ITQB). “Para não queimar a folha usa uma luz mais mortiça, mas também fica com uma visão mais imperfeita.”
Se assim é, qual é a vantagem da microscopia crioeletrónica? Tirar muitas fotografias e depois alinhá-las todas até ter uma fotografia de alta resolução. Mesmo que cada fotografia tirada nesta espécie de penumbra possa não apresentar muito detalhe, juntar as fotografias todas permite obter uma imagem que deixa ver cada átomo e cada ligação da molécula. E em três dimensões.
Com a cristalografia de raios X já era possível ver biomoléculas com uma resolução igualmente elevada, mas nem todas as proteínas (um dos tipos de biomoléculas estudado) podem ser cristalizadas, o que faz com que a técnica tenha as suas limitações. Além disso, a cristalografia de raios X funciona melhor com moléculas mais pequenas, enquanto a microscopia crioeletrónica permite estudar moléculas maiores. “São duas técnicas complementares”, diz Pedro Matias, investigador na Unidade de Cristalografia de Macromoléculas no ITQB.
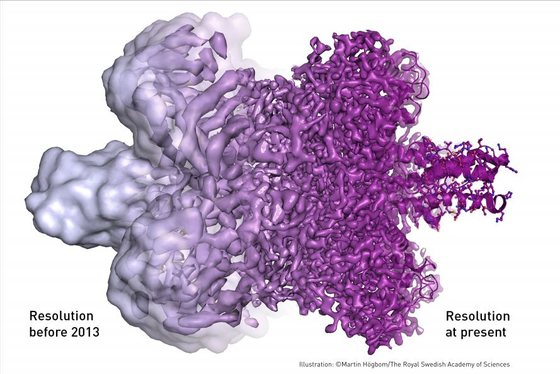
Diferença na resolução da estrutura de uma proteína antes e depois de 2013 – MartinHögbom/TheRoyalSwedishAcademyofSciences
Pedro Matias trabalha sobretudo com a cristalografia de raios X, mas espera que seja possível vir a ter um microscópio crioeletrónico em Portugal. “O ideal seria ter um microscópio topo de gama em Portugal, mas no mínimo ter um de desempenho médio”, disse o investigador. “É que sem mostrar alguns resultados nestes microscópios, que validem a metodologia utilizada, é impossível conseguir chegar aos microscópios de topo.”
Os microscópios crioeletrónicos existentes em grandes instituições europeias estão disponíveis para serem usados por outros grupos de investigação alheios à instituição. O problema é que são tão poucos que todos os minutos gastos nesses microscópios são preciosos. As equipas que os queiram utilizar têm de provar que têm a técnica afinada e que vão obter resultados válidos.
Pedro Matias reconhece quão importante é conhecer a estrutura celular, mas a sua área de investigação principal é mais aplicada à saúde. Conhecer a estrutura das proteínas envolvidas nas doenças humanas ou produzidas pelos agentes patogénicos (causadores de doenças) pode permitir criar fármacos que sejam mais eficazes no ataque a essas proteínas.
“Nos últimos ano, a literatura científica foi imagens de tudo e mais alguma coisa, de proteínas que causam resistência aos antibióticos à superfície do vírus zika”, lê-se no comunicado de imprensa divulgado pelo Comité do Nobel.
Quem poderia ter sido vencedor do Nobel da Química 2017?
Para o Nobel da Química, como para os restantes prémios Nobel, haverá sempre palpites sobre os possíveis vencedores. Este ano, quem apontava as ondas gravitacionais para o prémio Nobel da Física, teve o retorno da expectativa, mas nem sempre as apostas são refletidas nas escolhas do Comité do Nobel. Além disso, é impossível perceber se os investigadores preferidos estavam entre os nomeados desse ano, porque as listas de nomeados só são conhecidas ao fim de 50 anos.
Se quiser voltar um pouco atrás na história poderá conhecer todos os nomeados e laureados entre 1901 e 1966 num gráfico interativo do site Physics Today.
As apostas vão de preferências e palpites a métodos mais ou menos sistemáticos, como os da Clarivate Analytics. Todos os anos, esta empresa analisa os artigos científicos publicados à procura de potenciais candidatos aos prémios Nobel. Aqueles que atingem o topo das citações dentro da sua área de investigação têm mais probabilidade de serem laureados (conheça a lista de 2017 aqui). Pelo menos, assim assume a empresa.
Here are our followers' predictions for today's #ChemNobel. Bioortogonal chemistry, CRIPSR-Cas9 are also in the minds of our researchers. pic.twitter.com/L7J1g8QXDw
— ICIQ (@ICIQchem) October 4, 2017
O site Chemical & Engineering News (C&EN) promove anualmente um webinar (uma conferência online) sobre quem poderão ser os laureados na Química para esse ano. As votações de quem assistiu ao webinar escolheram dois temas principais: John B. Goodenough (entre outros) e o desenvolvimento das baterias de lítio; e Jennifer Doudna, Emmanuel Charpentier e Feng Zhang pelos primeiros passos dados com a técnica de edição genética CRISPR/Cas9.
Esta técnica de edição genética tem revolucionado a bioquímica porque tornou mais preciso eliminar, reparar ou trocar genes dentro de uma célula, sem falar que a técnica é mais rápida, fácil de utilizar e barata que as existentes. As dúvidas sobre a atribuição do Nobel recaem nas questões éticas, mas sobre na guerra de patentes entre os investigadores acima referidos, como destaca o site Fast Company.
Talvez por isso a Scientific American também volte a sua atenção para John B. Goodenough e as baterias de lítio. Afinal o investigador é um eterno candidato e já tem 95 anos. E não há prémios Nobel atribuídos a título póstumo.
Correção: Pedro Matias é investigador (e não coordenador) na Unidade de Cristalografia de Macromoléculas no ITQB















