Para expiar a morte do seu filho, o Rei de Creta mandou que a cidade de Atenas lhe enviasse 14 jovens, sete rapazes e sete raparigas, a cada sete anos. Uma vez chegados a Atenas, os jovens eram enviados para o Labirinto, em cujo centro vivia o Minotauro, uma criatura monstruosa com um corpo de homem e uma cabeça de touro. Se o Minotauro não matasse os jovens atenienses, estes eram condenados a vaguear pelo Labirinto tortuoso, primeiro perdendo o seu caminho e, eventualmente, as suas vidas.
Este tributo humano foi prestado duas vezes até que Teseu, um príncipe de Atenas, ocupou o seu lugar entre os 14 jovens. Quando o mito é recontado, a maioria das vezes toma-se por garantido que o herói derrota o Minotauro em combate, mas a luta física não é o cerne desta história – é como Teseu supera o desafio mental de percorrer o Labirinto. A par da sua espada, o herói leva consigo um novelo para traçar o seu caminho. Independentemente da profundidade do Labirinto, o novelo guiá-lo-á de volta em segurança.
A palavra inglesa para “novelo” (clew) está na origem da palavra que atualmente significa “pista” (clue) e as pistas são a melhor forma para resolver um mistério. Mostram-nos que um puzzle, por muito complicado que pareça, tem um uma solução simples. A vida real é mais confusa que os mitos e as ficções, mas continuamos a acreditar que, se conseguirmos juntar pistas suficientes, os nossos problemas podem ser reduzidos a algo controlável.
“Auguste D” – era o nome no arquivo de cartão azul. Auguste Deter, internada no Hospital para Doentes Mentais e Epilépticos de Frankfurt a 25 de novembro de 1901. O médico residente era o Dr. Alois Alzheimer, que a examinou no dia seguinte e ao longo dos três que se seguiram.
— Qual é o seu primeiro nome?
— Auguste.
— E o seu último nome?
— Auguste.
— Qual é o nome do seu marido?
— Auguste, penso eu.
— Do seu marido?
— Ah, o meu marido.
Com 51 anos, Deter sofria de um caso de demência invulgarmente severa e progressiva. O primeiro sintoma tinha sido os intensos ciúmes que sentira em relação ao marido. A sua memória começou a falhar rapidamente, sentia-se frequentemente desorientada e costumava esconder coisas no seu apartamento; por vezes, sentia que alguém a queria matar e começava a gritar. Morreu dentro de cinco anos.
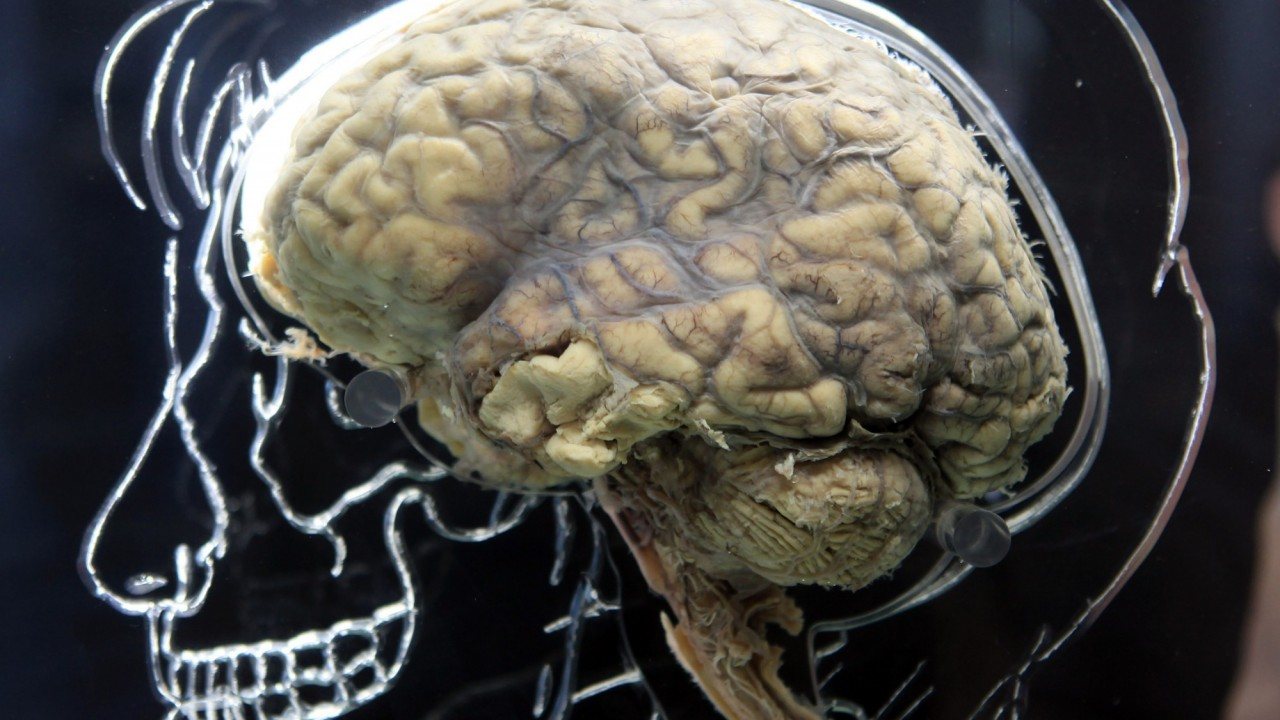
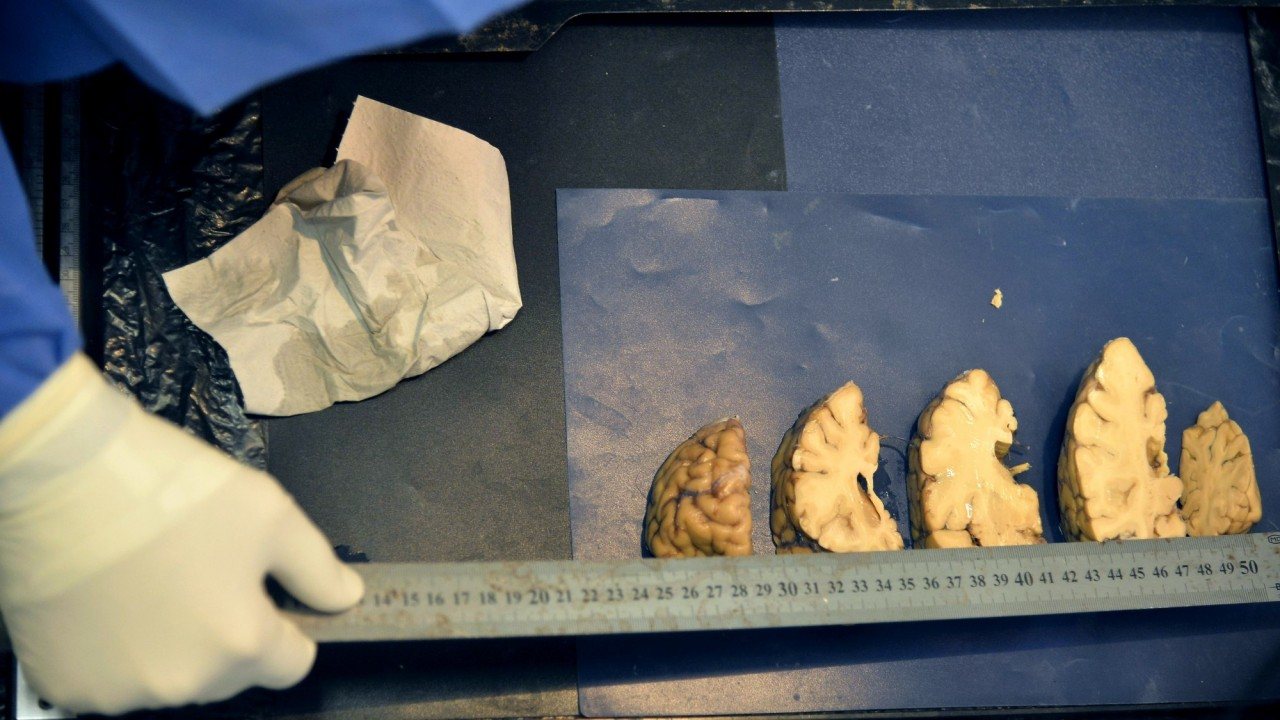
Por essa altura, Alzheimer tinha aceitado um trabalho em Munique, mas não conseguindo esquecer-se de Deter, conseguiu que lhe enviassem o seu cérebro após a morte da paciente. Ele queria, literalmente, entrar na sua cabeça, e ver o que 32 páginas de apontamentos médicos não tinham conseguido mostrar: a causa da sua degeneração mental. Alzheimer cortou fatias finas do seu cérebro e examinou-as ao microscópio, na busca de pistas.
O nosso cérebro é um labirinto escuro e húmido. As dobras e pregas dos quase 1,5 kg de tecido cerebral mole, seguros pelo nosso crânio, guardam outro labirinto mais complexo de células nervosas unidas na escuridão, estabelecendo ligações químicas e elétricas e formando percursos e circuitos que, de alguma forma, dão origem à consciência e à cognição, às memórias e aos pensamentos que nos definem. No cérebro de Deter, esse labirinto tinha-se transformado numa armadilha. Havia ligações que se tinham perdido, células em falta, memórias apagadas, intelecto destruído.
No cérebro de Deter, esse labirinto tinha-se transformado numa armadilha. Havia ligações que se tinham perdido, células em falta, memórias apagadas, intelecto destruído.
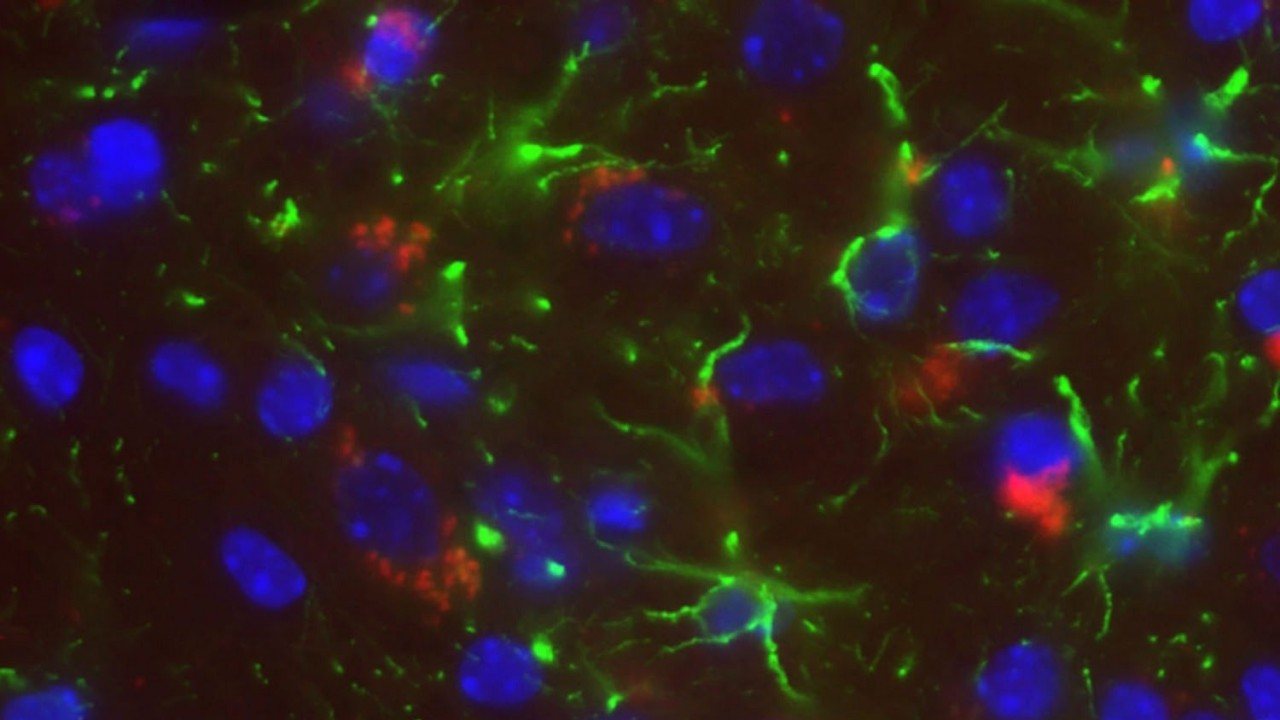
À medida que a ordem e a organização cerebrais eram destruídas, o cérebro de Deter fazia tentativas desesperadas para redirecionar os seus sinais, repetindo infindavelmente os mesmos ciclos errantes de pensamentos ou gerando ilusões bizarras e assustadoras. A rede neuronal entrelaçada, que em tempos lhe tinha permitido interagir com o mundo, acabou por tornar-se intransitável, coberta de placas nodosas e emaranhados – estas foram as pistas que Alzheimer encontrou.
Nas células nervosas de Deter, que de outro modo estariam saudáveis, muitas das fibras ao longo das extensões ramificadas eram invulgarmente grossas e inexpugnáveis – os “emaranhados”. Simultaneamente, encontravam-se entre as suas células pequenos maciços redondos, as “placas”. Parecia ser óbvio que estas placas e estes emaranhados – as marcas do que é atualmente designado como a doença de Alzheimer – fazem a diferença entre um cérebro saudável e um doente.
Matt Cardy/Getty Images
A ficção policial foi inventada em 1841 por Edgar Allan Poe. Inspirado pelas novas ciências que floresciam no início do século XIX, o escritor americano criou Monsieur C. Auguste Dupin, um detetive parisiense. Dupin era extremamente inteligente, observador e racional. Era também solitário e presunçoso, mas capaz de fazer fantásticas deduções, que acabavam com os mistérios mais intrincados. Os comentadores literários da época disseram que Poe havia transferido o centro da narrativa do coração para a cabeça: o romance e o drama foram sacrificados para dar lugar à lógica e ao raciocínio; os pensamentos contavam mais do que as ações.
As descrições que Alois Alzheimer fez de Deter acrescentaram uma nova construção aos manuais da medicina: uma forma rara de demência que ataca a memória, a auto-consciência e a capacidade racional e intelectual.
O primeiro caso de Dupin foi Os Assassinatos da Rua Morgue (“The Murders in the Rue Morgue”): duas mulheres tinham sido brutalmente assassinadas no quarto andar de um prédio, numa divisão que não permitia, aparentemente, escapatória possível – as janelas estavam fechadas por dentro, as chaminés demasiado estreitas para um gato sequer as poder trepar e uma multidão de vizinhos tinha bloqueado as escadas que davam para a porta trancada, com a chave na parte interior, enquanto ouviam os gritos horripilantes que vinham de dentro.
A cabeça de uma das mulheres tinha sido quase totalmente cortada do resto do corpo; o corpo da outra mulher tinha sido enfiado, de cabeça para baixo, pela chaminé acima. O mistério insolúvel para toda Paris – para já não falar da polícia – torna-se claro para Dupin devido às pistas (Poe utiliza a forma ortográfica “clews”) que ele encontra no local do crime. O assassino era, de facto, uma besta desumana – revelou tratar-se de um orangotango. Enquanto construção ficcional de um autor, o Monsieur Dupin era infalível em resolver mistérios também eles construídos. A vida real teria sido um desafio maior.

Hulton Archive/Getty Images
“A doença de Alzheimer é uma construção; todas as doenças são construções” diz o professor de Psiquiatria Geriátrica Simon Lovestone do Instituto de Psiquiatria da King’s College de Londres. “[As construções] são a nossa melhor tentativa para explicar o mundo.”
As descrições que Alois Alzheimer fez de Deter acrescentaram uma nova construção aos manuais da medicina: uma forma rara de demência que ataca a memória, a auto-consciência e a capacidade racional e intelectual, acompanhada por placas e emaranhados no cérebro que se desenvolvem muito mais cedo que a “demência senil”, a perda gradual de faculdades mentais que era tudo menos aceite como fazendo parte natural do processo de envelhecimento.
Esta definição ficou ameaçada na década de 1930, quando se descobriu que os cérebros de algumas pessoas idosas, aparentemente saudáveis, também tinham placas e emaranhados quando morriam. Se as pistas de Alzheimer fossem falaciosas e não dissessem, de todo, respeito à demência, não restaria nada para poder começar a compreender a doença.
A partir dos anos 60, os cientistas adotaram uma abordagem mais rigorosa. Em vez de simplesmente tomarem nota da presença ou ausência de placas ou emaranhados nos cérebros das pessoas, eles começaram a medir a sua quantidade e como é que esta estaria relacionada com o desempenho em testes cognitivos. De forma geral, havia um maior número de placas e emaranhados nos casos mais graves de demência, o que sugeria, de facto, que os dois estariam relacionados. Nos casos das pessoas que tinham placas e emaranhados mas que não sofriam de demência, podia ser que elas tivessem falecido antes do aparecimento de sintomas ou que os seus cérebros pudessem ter compensado a sua presença até certo ponto. Globalmente, os investigadores estavam convencidos que a doença de Alzheimer era real.
“Como médico, a doença de Alzheimer é para mim um paciente com um conjunto de sintomas característicos para quem não posso, neste momento, servir de grande ajuda.”
Na verdade, a doença de Alzheimer sofreu uma redefinição na década de 70 e passou a incluir qualquer pessoa com demência em cujo cérebro fossem descobertas placas e emaranhados aquando da sua morte. Isto acabou por incluir muito mais pessoas que teriam sido anteriormente diagnosticadas com “demência senil”, bem como aquelas que correspondiam à descrição inicial de Alzheimer. Esta nova construção tornou-se, de longe, a forma mais comum de demência – segundo a associação para a investigação da doença de Alzheimer no Reino Unido, cerca de meio milhão de pessoas no Reino Unido sofrem da doença de Alzheimer, o que corresponde a mais de 60 % de todas as pessoas com demência.
Para Lovestone, “a doença de Alzheimer diz respeito a um processo cerebral cuja manifestação se dá na forma de placas, emaranhados e perdas neuronais”. O cientista continua: “É definida por uma perda progressiva da cognição e da capacidade de funcionar no dia-a-dia”.
“As pessoas perdem as suas memórias, depois perdem a sua capacidade de desempenhar tarefas complexas e depois, progressivamente, tarefas mais simples, passando a precisar de assistência. E frequentemente isto é acompanhado por sintomas psicológicos e comportamentais, que vão desde distúrbios de sono a características claramente psicóticas.”
“Como médico, a doença de Alzheimer é para mim um paciente com um conjunto de sintomas característicos para quem não posso, neste momento, servir de grande ajuda.”

SEBASTIEN BOZON/ Getty Images
O corpo de Mary Rogers foi encontrado a flutuar no rio Hudson, na costa de New Jersey, a 11 de julho de 1841. Trabalhava numa tabacaria e foi descrita na imprensa como a “bonita rapariga dos cigarros”. A subsequente investigação deu aos jornalistas americanos uma ampla oportunidade para inventarem um manancial de teorias sensacionalistas. Alguns jornais afirmavam a culpabilidade do antigo patrão de Rogers, outros que ela tinha sido morta após uma violação em grupo, outros tinham ideais ainda mais rebuscadas.
Edgar Allan Poe pensou que podia fazer melhor. No ano seguinte, transladou os detalhes notórios do caso para Paris para que o Monsieur Dupin pudesse enfrentar o análogo Mistério de Marie Rogêt (“Mystery of Marie Rogêt”), publicado em série no Guia das Senhoras de Snowden (“Snowden’s Ladies’ Companion”). Contudo, antes de ele conseguir lançar o último capítulo e revelar o culpado, a vida real interveio: uma mulher tinha confessado no seu leito de morte que Rogers não tinha sido assassinada mas morrido durante um aborto mal executado na sua casa.
Ninguém foi condenado no caso de Rogers, em grande medida porque ninguém podia alguma vez ter certeza absoluta sobre aquilo que tinha acontecido. Na história de Poe, Dupin não se compromete com uma solução. Poe deixou o final inconclusivo, em vez disso discutindo a natureza da probabilidade e do erro na escolha de teorias competitivas.
A redefinição da doença de Alzheimer nos anos 70 atraiu mais atenções, mais dinheiro e mais investigadores. Todos tinham a sua própria teoria. John Hardy, um cientista que tinha chegado tão perto como qualquer outro de encontrar uma explicação convincente para a doença, diz que se tratava de um terreno onde tudo era possível: “As pessoas disseram que era por causa do alumínio, dos ‘vírus lentos’, dos danos oxidativos – não que alguma destas teorias estivesse 100 % errada, mas era simplesmente uma papa anárquica de ideias”.
“As pessoas disseram que era por causa do alumínio, dos ‘vírus lentos’, dos danos oxidativos – não que alguma destas teorias estivesse 100 % errada, mas era simplesmente uma papa anárquica de ideias.”
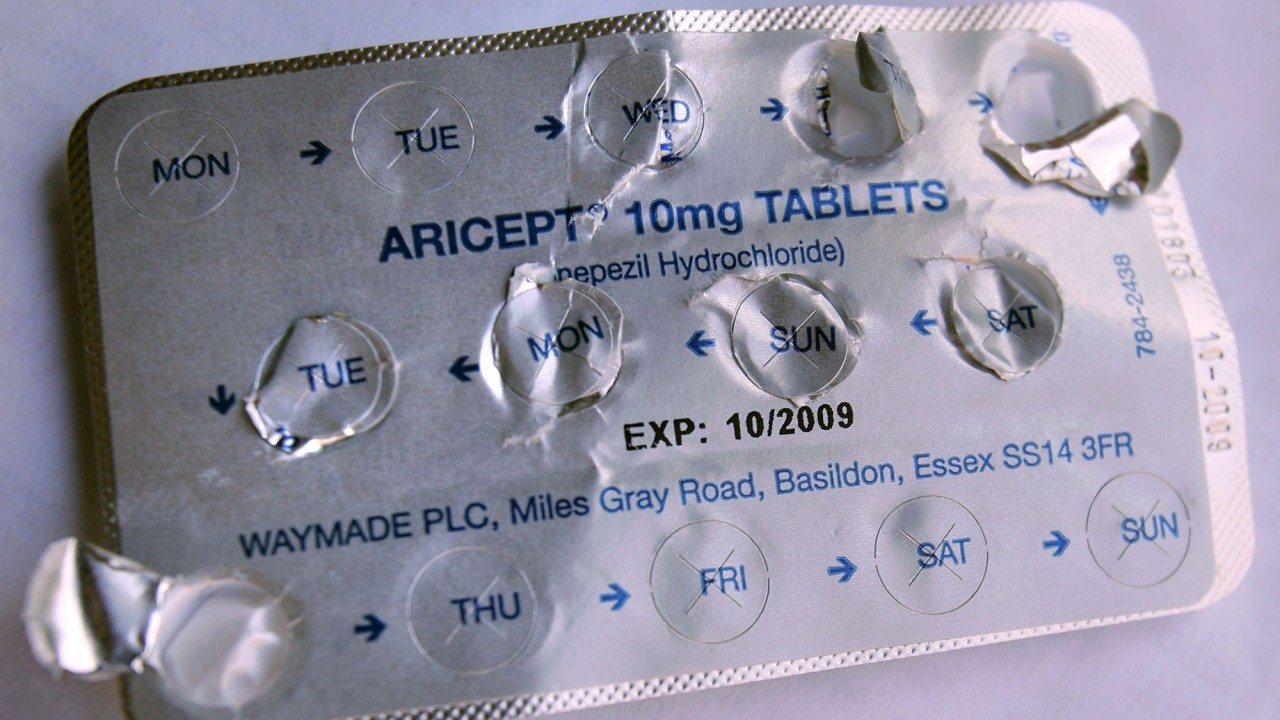
No entanto, dessa “papa” surgiu uma teoria simples que levou ao primeiro conjunto de tratamentos para a doença de Alzheimer. Os cientistas tinham descoberto que precisamos de um neurotransmissor chamado acetilcolina para formar memórias. Visto a memória ser a primeira coisa a desaparecer na doença de Alzheimer, e as células nervosas que usam acetilcolina parecerem especialmente vulneráveis, os investigadores estavam convencidos que isto podia ser a base para um tratamento. Desenvolveram medicamentos, como o Aricept, que estimulam a acetilcolina e ajudam a manter as funções dessas células nervosas específicas.
Teria sido uma solução relativamente simples para a doença de Alzheimer – se tivesse funcionado. Infelizmente, o benefício para os pacientes era de curta duração até que a doença voltasse a ganhar terreno e a degeneração mental continuasse. Ainda assim, não existe até à data um tratamento melhor além destes medicamentos imperfeitos.
Cate Gillon/Getty Images
Poe regressou à simplicidade elegante de um crime construído no terceiro e último caso de Dupin. Nele, o detetive tem de localizar A Carta Roubada (“The Purloined Letter”), que havia sido descaradamente furtada à Rainha de França. O ladrão, um político apenas designado por Ministro D—, acaba por ser a imagem espelhada de Dupin, o seu arqui-inimigo: tanto o detetive como o bandido são reconhecidos pelo seu génio e distinguem-se na matemática e na poesia. Estas semelhanças são deliberadas, já que Poe quer mostrar que um detetive tem de saber compreender e pensar como o seu oponente para o poder apanhar.
Quando é pedido a Dupin que ajude na investigação, já a polícia está no encalço do Ministro, fazendo buscas sub-reptícias à sua casa quase todas as noites dos últimos três meses. São usados microscópios para examinar as paredes, o chão, as mesas e até o interior das cadeiras, procurando indícios de que a carta tenha sido escondida. Só Dupin percebe que o Ministro D— teria antecipado uma meticulosidade daquele género, evitando qualquer tentativa para esconder a carta: logo, por muito improvável que pareça, ele não a terá escondido de todo.
Colocando um par de óculos como disfarce, Dupin convoca o Ministro. Ele repara numa carta suja e amarrotada que está num suporte barato de gesso. Embora não corresponda à descrição da polícia, Dupin deduz que este é, obviamente, o objeto roubado. Claro que se prova que ele tem razão, quando mais tarde rouba de volta a carta que tinha sido, simplesmente, dobrada em dois.
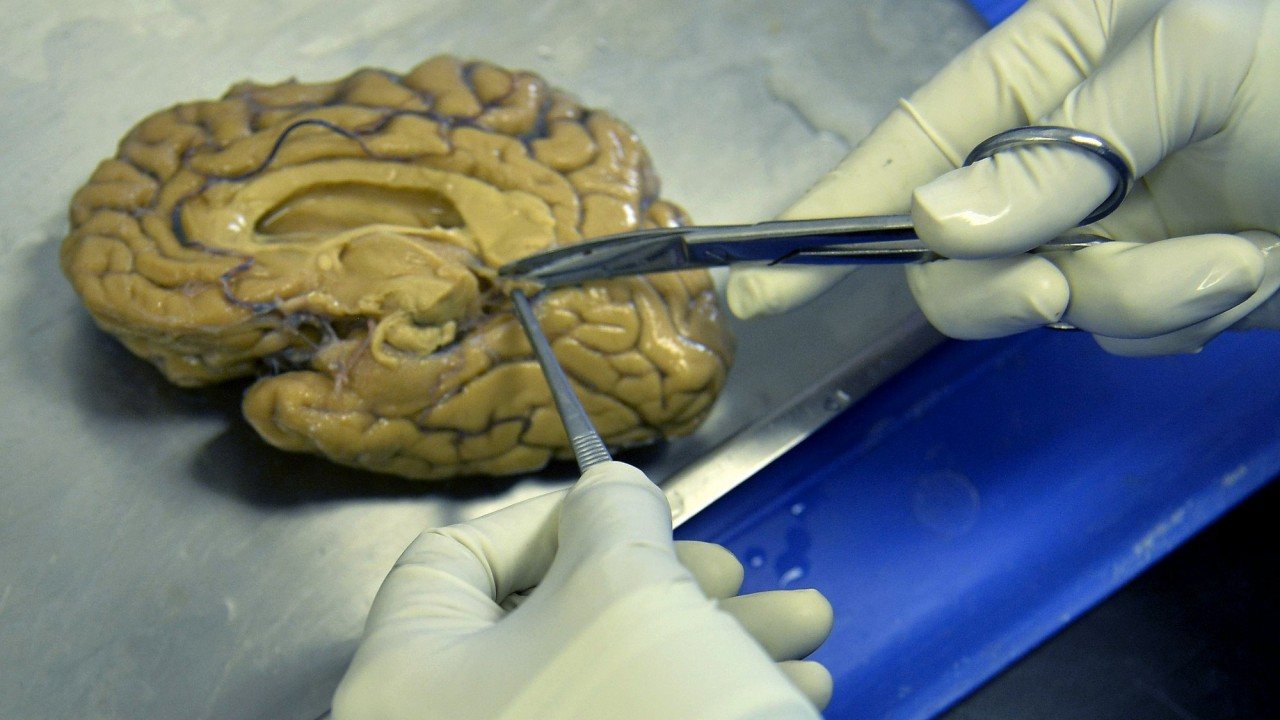
As placas e os emaranhados não tinham sido esquecidos entre as tentativas para explicar a doença de Alzheimer. Os cientistas analisaram as suas estruturas com microscópios ainda mais potentes e identificaram aquilo de que eram feitos. Os emaranhados consistiam de “tau”, uma proteína que habitualmente ajuda a manter a estrutura das células nervosas. Na doença de Alzheimer, a “tau” move-se para a parte errada das células, dobra-se a si mesma e forma filamentos em espiral que se acumulam e dão origem aos emaranhados. Outra proteína que pode dobrar-se a si mesma é o amiloide beta. Esta proteína é formada a partir de uma outra mais comprida chamada proteína precursora do amiloide (PPA), mas ninguém sabe se cumpre uma função específica no corpo humano. Na doença de Alzheimer, o amiloide beta dobra-se mal e forma fibras longas que se acumulam e se transformam em placas
Tendo andado de mão em mão durante décadas, as placas e os emaranhados haviam sido divididos segundo as diferentes proteínas que os constituíam e que agora se conheciam. Procurando uma explicação simples para a doença, os cientistas exigiram que uma ou outra fosse a causa – porque era improvavelmente complicado as duas proteínas estarem igualmente envolvidas. De forma inevitável, as pessoas escolheram o seu partido: era o amiloide versus a tau.
O lado do amiloide tomou a dianteira. John Hardy e os seus colegas fizeram uma descoberta na genética da doença de Alzheimer e desenvolveram a “hipótese da cascata amiloidal”. Esta tornou-se, rapidamente, a explicação dominante para a doença e direcionou a maior parte dos esforços de investigação desde que surgiu. Está tão bem estabelecida, que até desempenhou um papel central no enredo de um drama britânico de detetives a passar em horário nobre em 2013.
RAUL ARBOLEDA/AFP/Getty Images
Hardy ri-se quando se lembra do episódio Lewis, onde um investigador de Alzheimer é surpreendido pelo detetive que dá o nome ao episódio, num caso de assassínio. “Ele encontrou o corpo num sótão de um departamento da universidade de Oxford. Descobriu-se que era o corpo de uma aluna de doutoramento que tinha sido morta por uma supervisora muito glamorosa. A estudante tinha desenvolvido a hipótese da cascata e a supervisora tinha-lha roubado.”
Não foi bem assim que aconteceu na vida real. No final da década de 1980, Hardy estava a competir com muitos outros cientistas à volta do mundo para encontrar o “gene do Alzheimer”. Todos estavam a estudar famílias com muitos casos de demência grave, o tipo de demência que começa a afetar pessoas nos seus 40 ou 50 anos, em vez das pessoas acima dos 65. Uma vez que a doença era comum nestas famílias, era provável que houvesse um fator genético consistente que causasse a doença de Alzheimer naqueles que a herdavam em cada geração.
“É muito mais fácil descer um rio do que subi-lo”, explica Hardy. “Em vez de olhar para o cérebro e tentar descobrir o que aconteceu no passado, podíamos encontrar o gene e perceber o que tinha acontecido de ora em diante.”
A competição foi fortemente disputada, com passos atrás e em falso. Eventualmente, em 1991, a equipa de Hardy ganhou, identificando as primeiras mutações genéticas associadas à doença de Alzheimer – e todas estavam no gene do amiloide. Pouco tempo depois, outros grupos de investigação encontraram mutações diferentes no gene do amiloide associadas à doença e ainda em dois outros genes que ajudam a controlar o amiloide beta. Eram fortes indícios de que uma anomalia no amiloide beta pode espoletar a doença de Alzheimer.
Na hipótese da cascata amiloidal, que Hardy e os seus colegas formalizaram no ano seguinte, tudo seguia uma sequência: a formação de placas, emaranhados, células nervosas que falham e morrem e demência progressiva como resultado final. A sua ordem linear fez dela uma explicação apelativa.
“O que a hipótese amiloidal tem de bom é que obriga as pessoas a pensar sobre a doença de forma simples”, diz Hardy. “De repente, toda a gente tinha uma estrutura para enquadrar as suas experiências.”
“Podia estar errado – bom, errado não, mas não completamente certo -, mas havia um enquadramento.”
O enquadramento foi bem recebido pela indústria farmacêutica, que começou a desenvolver medicamentos que impedissem a cascata, ao bloquearam a produção ou acumulação do amiloide beta. Teria sido uma solução relativamente simples para a doença de Alzheimer – se tivesse funcionado. Nos últimos 15 anos, mais ou menos, foram criados medicamentos atrás de medicamentos que atuavam no amiloide beta, mas nenhum conseguiu fornecer benefícios suficientes a pacientes suficientes para que pudessem ser considerados eficazes. Das dezenas de medicamentos que foram testados nesse período de tempo, alguns foram retirados devido a efeitos secundários nocivos; outros não conseguiram, simplesmente, atrasar suficientemente o declínio mental dos pacientes ou ajudá-los no seu dia-a-dia.
O fracasso destes medicamentos não quer dizer, necessariamente, que a hipótese amiloidal esteja errada – Hardy e outros cientistas apontam um número de falhas na forma como muitos destes medicamentos são testados. Por outro lado, pode querer dizer que a hipótese precise de ser refinada: talvez o amiloide beta inicie a cascata, que depois é sustentada por outra coisa. Mas os testes clínicos não conseguiram dar uma resposta concreta, para a frustração de Hardy: “O resumo de todos esses testes é que não sabemos realmente. É como ler folhas de chá”.
“Costumava tentar arranjar a minha moto e se não consegues fazer sequer com que ela pegue, estás lixado. Mas quando consegues dar-lhe alguns toques e ela apenas precisa de ser afinada, isso é muito mais fácil.”
Contudo, um dos medicamentos mais recentemente testados, “soanezumab”, mostrou ter algum efeito em pessoas com casos mais leves da doença de Alzheimer – o suficiente para voltar a ser testado unicamente em pessoas nos estágios iniciais da doença. Se se confirmar o seu efeito, este medicamento poderá, potencialmente, ser usado para tratar pessoas quando os sintomas se começam a manifestar ou até como tratamento preventivo para pessoas com evidência de placas mas que ainda não apresentam sintomas. Qualquer coisa positiva que saísse destes testes “falhados” seria algo a poder ser explorado: “Se algum destes medicamentos começar a funcionar, mesmo que os efeitos sejam pequenos, seremos capazes de decifrar o Alzheimer”, diz Hardy.
“Costumava tentar arranjar a minha moto e se não consegues fazer sequer com que ela pegue, estás lixado. Mas quando consegues dar-lhe alguns toques e ela apenas precisa de ser afinada, isso é muito mais fácil.”
WALTRAUD GRUBITZSCH/EPA
Embora ninguém duvide das descobertas genéticas na doença de Alzheimer, a hipótese amiloidal não curou as divisões entre o campo do amiloide e o da tau – quanto muito, fê-las maiores e mais crispadas.
Michael Goedert fazia parte da equipa que identificou a tau como um dos principais constituintes dos emaranhados, em 1988; ele tem estado concentrado na tau desde então. Quando se descobriu que o amiloide beta era o elemento comum entre as mutações genéticas, Goedert reconheceu a sua importância como um primeiro passo no caminho para a doença, mas não gostou de algumas interpretações que se seguiram acerca do papel da tau.
“Levou a que muitas pessoas dissessem que os emaranhados eram algo que não tinha consequências. Pior do que um subproduto: um subproduto inócuo”, diz ele. “Não acreditei nisso, mas a pressão era muita, não se podia ignorar. Houve um período de sete anos e havia um vencedor – bom, não só nestas batalhas, mas parecia ser claro quem tinha ganho a batalha.”
A investigação sobre a tau tornou-se profundamente antiquada. Aqueles que persistiram nos anos 90, referem que foi extremamente difícil obter financiamento ou publicar os seus resultados nas revistas científicas mais prestigiadas.
A retratação chegaria em 1998, quando um grupo de cientistas – incluindo Hardy, que diz agora ter publicado muito mais sobre a tau do que o amiloide – descobriu que uma forma rara de demência era causada por mutações no gene da tau. Isto significava que a dobra incorreta da tau podia provocar danos às células nervosas e, desta forma, era improvável que ela fosse apenas um espectador inocente à doença de Alzheimer.
A propagação de emaranhados no cérebro tem uma relação muito mais estreita com a progressão da doença de Alzheimer do que as placas. Quando se descobriu que a tau podia causar danos, a hipótese amiloidal foi atualizada para acomodar a ideia de que podia ser a tau, não o amiloide beta, a matar as células nervosas que causam demência. “Podemos dizer que a disfunção da PPA [amiloide] é o catalisador de todo o processo, mas a disfunção da tau é o seu carrasco”, diz Goedert.
GOETTINGEN UNIVERSITY FACULTY OF MEDICINE/HANDOUT/EPA
No entanto, há alguns cientistas que vão ainda mais longe, dizendo que a tau é a verdadeira força motriz por trás da doença de Alzheimer. Segundo eles, a razão pela qual o gene da tau não foi relacionado à doença prende-se com o facto de os emaranhados serem um fenómeno natural no envelhecimento do cérebro. Para a maioria das pessoas, isto só se torna um problema na velhice quando os emaranhados bloqueiam muitas das ligações, de forma semelhante a como os músculos ficam mais fracos com a idade. Na doença de Alzheimer, existe outro fator – talvez a falta ou o excesso de amiloide beta – que faz com que os problemas ocorram mais cedo e progridam mais depressa.
De qualquer forma, as pessoas com Alzheimer podem muito bem beneficiar de tratamentos que bloqueiam a tau. Há medicamentos desse género a serem desenvolvidos, mas o campo da tau ainda está atrasado em relação ao do amiloide.
Apenas um medicamento da tau chegou à fase final de ensaios e ganhou controvérsia, especialmente por causa do homem responsável pelo seu desenvolvimento.

SEBASTIEN BOZON/AFP/Getty Images
Em 1907, o mesmo ano em que Alzheimer publicou o seu primeiro relatório sobre o caso de Auguste Deter, um romancista francês chamado Gaston Leroux lançou O Mistério do Quarto Amarelo (“Le Mystère de la Chambre Jaune”). Devendo muito às narrativas de detetives de Poe, contava a história de uma tentativa de crime num quarto do qual não havia, aparentemente, escapatória possível. A inovação de Leroux foi a de criar detetives rivais, pondo um jovem e brilhante jornalista de investigação contra um detetive grisalho e experiente contratado pela polícia para ajudar nas investigações.
A reviravolta dá-se quando se descobre que um dos investigadores de Leroux é o culpado. Este esbatimento da linha que separa o detetive do bandido salientou o que Poe tinha, instintivamente, reconhecido quando fez o detetive Dupin e o criminoso Ministro D— tão semelhantes, partilhando uma inteligência brilhante, um engenho matemático e uma imaginação poética. Desde então, quase todos os detetives ficcionais partilham esta ambiguidade: para obter resultados é preciso, às vezes, atravessar a linha; não é possível jogar sempre estritamente segundo as regras.

Fox Photos/Getty Images
Claude Wischik nasceu em França e cresceu na Austrália. Estudou matemática e filosofia, interessou-se por teatro e cinema e depois voltou à universidade para tirar medicina. Tendo decidido especializar-se em psiquiatria, foi para o Reino Unido – para o Laboratório de Biologia Molecular do Conselho de Investigação Médica de Cambridge (LBM) – para obter o seu doutoramento.
Juntou-se a uma pequena equipa, que tentava identificar a proteína presente nos emaranhados da doença de Alzheimer. A sua primeira tarefa foi purificar amostras para que contivessem apenas os filamentos dos emaranhados. Wischik teve dificuldade na tarefa, por isso um colega sugeriu-lhe que usasse nas amostras um composto chamado alcian blue. Longe de as purificar, Wischik ficou horrorizado quando o composto fez com que os emaranhados desaparecessem.
Eventualmente, foram capazes de purificar os emaranhados. Por esta altura já tinha chegado à equipa Michel Goedert e conseguiram, entre todos, provar que os emaranhados do Alzheimer eram constituídos pela tau. Mas, no espaço de alguns anos, Wischik tinha saído da equipa. Ele tinha discordado dos outros sobre o que fazia a tau acumular-se no cérebro ao longo da progressão da doença de Alzheimer. Debatendo-se já com o domínio do amiloide beta, o campo da tau não podia suportar mais divisões.
“Eu era mesmo a ovelha negra no LBM”, refere Wischik, “e foi por isso que tive de sair de lá”. Formou-se em psiquiatria e arranjou trabalho como diretor do Laboratório do Banco Cerebral de Cambridge, através do qual pôde continuar a sua investigação sobre a doença de Alzheimer e a tau.
Não se tinha esquecido do composto que dissolvera os emaranhados. Até encontrou outros que faziam o mesmo ou melhor ainda. O melhor de todos era um corante chamado methylene blue e Wischik estava convencido de que se tratava da base para um medicamento capaz de desfazer os emaranhados da tau: “Decidi que, no meio desta guerra entre o amiloide e a tau, a única forma de ganhar é ganhando. A única forma de ganhar é desenvolver um tratamento que resulte”.
Anos mais tarde, Goedert viu Wischik na televisão. A BBC estava a fazer uma transmissão a partir de Chicago da Conferência Internacional de 2008 sobre a doença de Alzheimer, onde Wischik tinha acabado de fazer um comunicado importante. Goedert lembra-se da entrevista: “Ele disse que a sua descoberta era a mais importante desde a descrição que Alzheimer havia feito da doença”.

BERND WUESTNECK/EPA
Foi sorte pura. O pai de um dos colegas de turma do filho de Wischik era, por acaso, um cirurgião e um investidor de capital. Ele ofereceu a Wischik a oportunidade financeira de que precisava. Juntos criaram uma empresa, a TauRx Therapeutics, angariando dinheiro para transformar a methylene blue num medicamento destruidor de emaranhados de pleno direito.
Em 2008, anunciaram os resultados de um ensaio clínico com 321 casos, no qual o seu medicamento tinha conseguido, em dois anos, abrandar a regressão mental em pessoas com doença de Alzheimer em 90%, comparado com aquelas que tomaram o placebo. Em 2012, TauRx tinha conseguido angariar 200 milhões de dólares (cerca de 180 milhões de euros) para levar a cabo o último estágio dos testes aos medicamentos – um ensaio clínico envolvendo várias centenas de pacientes espalhados por 22 países.
Wischik tinha claramente persuadido investidores privados a apoiar a sua ideia. Convenceu os reguladores da Agência Europeia de Medicamentos e a Administração de Alimentos e Medicamentos (FDA) dos EUA que os pacientes não corriam riscos ao experimentarem o medicamento. Mas ainda não tinha conseguido convencer a comunidade de investigação da doença de Alzheimer.
“Pensei que, uma vez anunciados os dados, isto seria simplesmente aceite”, diz Wischik, “mas fui verdadeiramente criticado”. O que preocupa os outros investigadores é que o novo ensaio vai ser feito antes de os dados completos do ensaio anterior terem sido revistos pelos colegas e publicados na literatura científica para que possam ser escrutinados por todos. Até esse momento, eles não tinham muito mais do que a sua palavra sobre a eficácia do medicamento: “Tudo o que posso dizer é que ele devia publicar o seu trabalho”, explica Goedert. “Depois podíamos ter a certeza.”
Wischik está mais preocupado com os resultados futuros do que em escrever os dados do passado. “Vamos publicar os malditos resultados”, diz Wischik. “Tenho dez artigos que preciso de escrever, mais os planos de negócios e as relações de investimento e as patentes e tenho de andar por aí a implorar por dinheiro, gerindo a equipa – e a minha mulher grita comigo por eu não escrever os artigos. Vou escrevê-los, mas preciso só de um pouco de espaço para o fazer e esse espaço parece não surgir”.
RAUL ARBOLEDA/AFP/Getty Images
Com apenas três contos, Edgar Allan Poe criou a ficção policial, um género agora tão omnipresente que parece estranho pensar que alguém o teve de inventar. Monsieur Dupin, o arquétipo do detetive, foi copiado, transformado e reinventado inúmeras vezes deste então.
Um dos admiradores de Poe foi o escritor argentino Jorge Luis Borges que, em 1941, – precisamente cem anos após Os Assassinatos da Rua Morgue – começou a publicar o seu próprio trio de histórias de detetives: O Jardim dos Caminhos que se Bifurcam (“El Jardín de senderos que se Bifurcan”), A Morte e a Bússola (“La Muerte y la Brújula”) e Ibn-Hakam al-Bokhari, Morto no Seu Labirinto (“Abenjacán el Bojarí, Muerto en su Laberinto”).
Esta não foi uma simples homenagem: Borges dobrou o género sobre si mesmo, aprisionando os detetives em labirintos figurativos e literais, à medida que cada caso se torna cada vez mais complicado. O êxito e o fracasso são redefinidos, com os protagonistas a serem consumidos por casos que ficam, muitas vezes por resolver, mesmo quando a solução é revelada.
As construções de Borges são mais elaboradas que as de Poe. São alertas auto-conscientes contra a assunção de que cada puzzle tem uma pista que pode ser seguida até à compreensão. E como diz uma das personagens de Borges: “Não é preciso construir um labirinto quando o mundo inteiro o é”.

David Ramos/Getty Images
Aqueles que perderam um familiar ou um amigo com Alzheimer dizem muitas vezes que é como se essa pessoa morresse duas vezes – primeiro a mente e depois o corpo, sem saberem quem são, o que são e/ou onde estão. Face a uma doença que aprisiona as pessoas no seu próprio cérebro degenerativo, a nossa tendência poderá ser reconstruir essa doença e toda a sua complexidade na esperança de compreendê-la. Mas o que os cientistas nos dizem para fazer, realmente, é construir uma linha que nos guie para fora do labirinto.
“Sim, o mundo é complicado – sabemos isso”, diz o psiquiatra Simon Lovestone, “mas se queremos entender o mundo, a abordagem que tem sido mais útil na história da humanidade é reduzi-lo a elementos tratáveis”. Por outras palavras, fazer construções mais simples a partir das evidências. A teoria baseada na acetilcolina e na memória foi uma tentativa, tal como é a hipótese da cascata amiloidal e tal como é a ideia de que tem tudo a ver com a tau.
Se o medicamento de Wischik for bem sucedido, ele proclamar-se-á vencedor na guerra do “amiloide versus tau”. Finalmente haveria algo com que se pudéssemos trabalhar, afinar e criar formas mais eficazes de tratar a doença de Alzheimer. Mas não provaria a sua teoria exclusiva da tau para a doença: um medicamento para o Alzheimer que dissolve os emaranhados no cérebro seria na mesma eficaz, ainda que a função destrutiva dos emaranhados fosse espoletada pelo amiloide beta.
Se o seu medicamento LMTX funcionar, pode ser que nada disso tenha interesse; se falhar, continuaremos sem saber como é que os emaranhados se formam, a extensão do envolvimento do amiloide beta ou a veracidade da hipótese da cascata amiloidal.
E a própria hipótese amiloidal pode não ser tão simples como inicialmente prometia ser: “Se tivesse uma crítica para a área”, diz Lovestone, “é a de que não assumimos, de forma séria, o facto de que existe uma cascata que precisamos, realmente, de desobstruir”. Embora a hipótese amiloidal apresente uma série curta de passos que explicam como uma falha desencadeia a doença de Alzheimer, ainda não compreendemos as ligações potencialmente complicadas que unem cada passo.
Enquanto os tratamentos com base no amiloide ainda estão retidos em fase de teste, os cientistas investigam com maior profundidade as falhas na hipótese amiloidal, acrescentando às pistas que têm, mas ameaçando a sua simplicidade original.
Alguns ainda estão a tentar provar que o amiloide beta pode ser diretamente tóxico para as células nervosas, outros estão a tentar perceber o papel do sistema imunitário, que causa inflamações nos cérebros das pessoas com Alzheimer. John Hardy diz que o elemento que falta no quebra-cabeças é descobrir a função normal do amiloide beta.
Todos sabem que o envelhecimento é o o maior fator de risco da doença de Alzheimer e desvendar essa ligação também não será, provavelmente, um percurso simples. Entretanto, há relatos de que a demência pode estar relacionada com a diabetes, a higiene, o cobre, o álcool, a obesidade, doenças gengivais, entre outros fatores. Com esta nova multiplicação de teorias, existe o perigo de que a investigação esteja a criar o seu próprio labirinto, confundindo a compreensão e bloqueando até os cientistas que buscam uma solução.
Hardy escreveu que, se Auguste Deter fosse viva hoje, “o seu triste prognóstico seria muito semelhante ao de 1906”. A doença de Alzheimer pode muito bem ser uma construção, mas sem que haja nenhum autor que nos diga onde está a resposta, estamos essencialmente perdidos. Podemos estar nas profundezas do labirinto ou a dois passos de encontrar a saída. A única solução é seguir todas as linhas possíveis, esperando de cada vez tratar-se da pista que nos leve para fora dele.
Tradução: Xénon Cruz


















