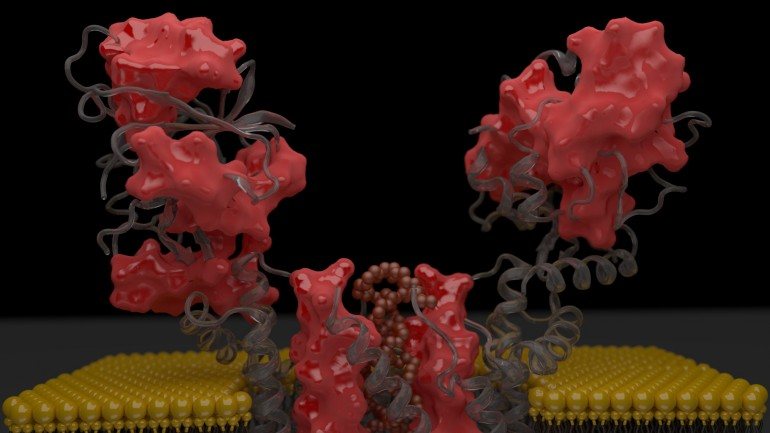
Uma equipa liderada por investigadores do Instituto de Tecnologia Química e Biológica (ITQB), apresenta esta quinta feira, na Nature Communications, a primeira estrutura em 3D de uma proteína. Na investigação estiveram também envolvidos cientistas de instituições de França, Alemanha, Rússia e Reino Unido.
As proteínas são moléculas complexas que desempenham funções importantes na vida dos organismos. As diferentes combinações entre os aminoácidos – existem no total 20 – que constituem a sequência e a forma como as cadeias proteicas se enrolam, dobram e criam ligações entre os próprios aminoácidos vão condicionar a função da proteínas. Perceber a estrutura da proteína, em particular a estrutura tridimensional, permite conhecer melhor a função.
Neste caso, a equipa do ITQB trabalhou a estrutura tridimensional de uma proteína pertencente à família das fosfotransferases – proteínas responsáveis pela síntese de fosfolípidos, constituintes principais da membrana das células. O estudo coordenado por Margarida Archer, investigadora no Laboratório de Cristalografia de Proteínas Membranares do ITQB, permitiu identificar a localização do centro ativo – sequência de oito aminoácidos comum em todas as proteínas da mesma família – e os dois sítios de ligação dos substratos – os substratos combinados irão originar um produto, como um fosfolípido.
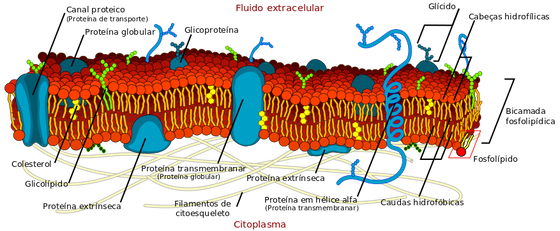
Estrutura da membrana celular com a camada de fosfolípidos e proteínas – LadyofHats/Wikimedia Commons
A proteínas membranares, como a estudada, apresentam desafios adicionais, refere a investigadora – como estão embebidas numa membrana lípidica não são solúveis em água. É preciso testar qual o melhor detergente para a isolar do resto dos componentes da membrana, replicá-la dentro de um organismo onde normalmente tem um comportamento tóxico e cristalizá-las (agregar as proteínas numa estrutura cristalina). O detergente essencial na purificação acaba por se mostrar um obstáculo na cristalização.
As dificuldades encontradas na purificação e cristalização de proteínas membranares explica, segundo Margarida Archer, porque é que das 100 mil estruturas tridimensionais presentes no Banco de Dados de Proteínas apenas 1.500 são proteínas membranares.
Atacar a tuberculose pela proteína
Neste caso, as proteínas da mesma família têm o centro ativo, com oito aminoácidos, bem conservado mas o número de aminoácidos na cadeia proteica é variável – pode ir dos 150 aos 400. Também o produto final da reação catalizada pela enzima (proteína) é variável dentro da família, enquanto a maior parte das fosfotransferases colabora na síntese de fosfolípidos, a proteína estudada produz um composto termoprotetor quando sujeita a temperaturas elevadas.
Esta enzima existe na membrana de Archaeoglobus fulgidus, um organismo unicelular extremófilo – cresce em zonas com altos teores de enxofre, como as fontes termais, e a temperatura ótima de crescimento está entre os 60º C e os 85º C. Por serem organismos muito resistentes e por terem proteínas estáveis sob altas temperaturas, tornam-se mais fáceis de produzir e manusear em laboratório.
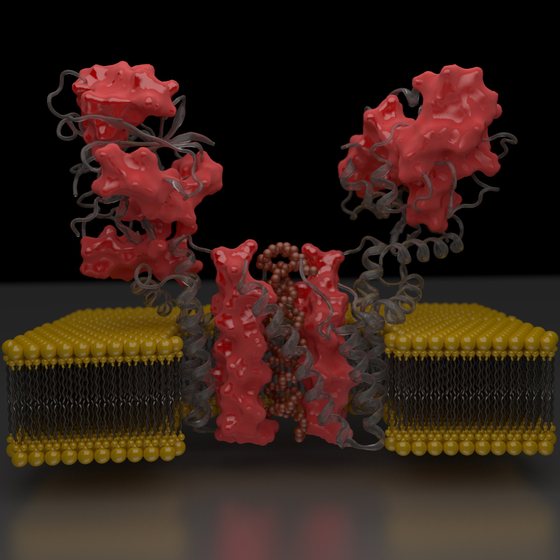
A membranas biológica é formada por uma camada bilipídica (cinzento) com extremidades/cabeças polares (amarelo) de fosfolípidos – Autor: David Cruz, cedido por ITQB
Após quase quatro anos a estudar esta proteína a equipa pode agora dedicar-se a estudar a estrutura tridimensional de outras proteínas da mesma família, como a que existe na Mycobacterium tuberculosis, causadora da tuberculose. “Conhecendo a estrutura pode ativar-se, inibir-se ou corrigir-se a enzima essencial a determinada via metabólica”, refere a investigadora.
Descobrir como inibir esta bactéria pode permitir à indústria farmacêutica criar um medicamento contra a tuberculose. “Se souber a forma da fechadura da porta consigo desenhar a chave para essa fechadura”, ilustra Margarida Archer. No entanto, como a proteína de Mycobacterium tuberculosis é muito semelhante à humana, é necessário descobrir onde reside a diferença para que o medicamento que venha a ser criado não afete a enzima humana.
No mesmo dia em que a equipa do instituto português publica os resultados da investigação, uma equipa norte americana, da Universidade Columbia em Nova Iorque, publica um estudo complementar na mesma revista. O contacto entre as duas equipas com trabalhos semelhantes acaba por se tornar uma parceria que poderá ser ainda mais evidente na análise da estrutura da proteína da Mycobacterium tuberculosis.
Prémio Nobel de estruturas 3D
A primeira estrutura tridimensional de uma proteína membranar valeu um prémio Nobel em 1988. Os laureados, Johann Deisenhofer, do Instituto Médico Howard Hughes (IMHH), nos Estados Unidos, e Robert Huber e Hartmut Michel, do Instituto Max Planck, na Alemanha, revelaram a estrutura de uma proteína bacteriana com funções fotossintéticas.
Em 2012 o estudo de proteínas, em particular os locais de ligação de hormonas e a posterior transmissão do sinal, valeu um prémio Nobel a Robert Lefkowitz, do IMHH e Centro Médico Universitário Duke, e Brian Kobilka, Escola de Medicina da Universidade de Stanford, nos Estados Unidos.