Há mais de 20 anos que a equipa de Manuela Pereira, investigadora no Instituto de Tecnologia Química e Biológica, estuda os mecanismos bioquímicos de uma bactéria açoriana, a Rhodothermus marinus, em particular os mecanismos que permitem converter os alimentos em energia. Agora conseguiram ver, pela primeira vez em três dimensões, o complexo de proteínas responsável por este processo. Os resultados foram publicados esta segunda-feira na revista científica Nature Communications.
A primeira pergunta que se coloca (e antes de seguirmos para a ciência propriamente dita) é se ao fim de 20 anos ainda dá para continuar a descobrir coisas novas sobre uma bactéria? “Dá, dá. Até sobre uma proteína. Basta olhar para a hemoglobina [proteína dos glóbulos vermelhos] conhecida há tanto tempo e que ainda hoje é estudada”, responde rapidamente Manuela Pereira. “As bactérias são organismos complexos. Podíamos ter mais 100 anos de investigação [com esta bactéria], porque o conhecimento não se esgota.”
A bactéria Rhodothermus marinus presta-se bem a esta função de ter algo novo para revelar, o que parece estar relacionado com a sua forma de vida. É uma bactéria que precisa de temperaturas altas, acima de 65º Celsius, para crescer e reproduzir-se, mas ao mesmo tempo depende do oxigénio para viver, respirar e produzir energia. Por isso vive num equilíbrio especial na coluna de água: fundo o suficiente para apanhar as correntes quentes, mas suficientemente próximo da superfície para ter contacto com as águas frias carregadas de oxigénio.
Assim é fácil perceber que esta bactéria não aparece por aí em qualquer sítio. Foi descrita pela primeira vez em fontes termais na Islândia, em 1988. Foi encontrada mais tarde noutros ambientes geotérmicos como Stufe di Nerone, perto de Nápoles (Itália) ou a ilha de Monserrat no mar das Caraíbas. Em Portugal, foi descoberta nos Açores, na praia da Ribeira Quente (São Miguel). A variabilidade é tanta que as comunidades de cada uma destas localizações, ainda que da mesma espécie, são geneticamente diferentes.
A grande maioria das bactérias que vive em ambientes extremos (extremófilas), abdicaram do oxigénio e usam outras moléculas nos processos de produção de energia, por isso, nesse sentido, a Rhodothermus marinus está mais próxima das mitocôndrias dos organismos multicelulares, como o homem. Mas depois usa mecanismos completamente diferentes e por isso desperta tanto interesse na investigadora portuguesa.
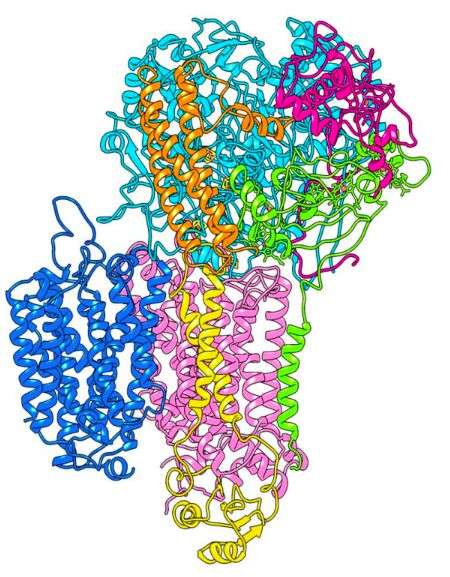
O complexo proteico (com cada proteína representada de uma cor) responsável pela respiração na bactéria ‘Rhodothermus marinus’, agora visto em 3D graças à criomicroscopia eletrónica — Manuela M. Pereira Lab/ITQB
Estudar as proteínas desta bactéria e compará-las com os bancos de genes existentes, permitiu à equipa de Manuela Pereira classificar e organizar, pela primeira vez, todas as proteínas que interagem com o oxigénio. Um trabalho que já concluíram há mais de 10 anos.
Agora o foco era num complexo proteico que tem como função converter metabolitos (resultantes da digestão do alimento das bactérias) em energia. Isto é, a proteína que se encontra na membrana celular ajuda a separar as cargas negativas (para dentro) das cargas positivas (para fora) — como uma pilha que acumula energia —, depois, quando a célula precisa, essa energia é libertada.
Os investigadores já conheciam a proteína que lhes poderia interessar, mas nunca a tinham visto em três dimensões. E é a estrutura das proteína, a forma como organiza a cadeia molecular, que define a sua função — sem a ver a três dimensões, é praticamente impossível de saber.
A cristalografia de raios-X (que usa a difração por raio-X para determinar a estrutura dos cristais ou moléculas) é a técnica mais utilizada para conhecer a estrutura das proteínas, mas não funciona bem com moléculas muito grandes ou com moléculas da membrana celular — que era o caso da proteína em estudo. A criomicroscopia eletrónica, cujo desenvolvimento valeu o prémio Nobel da Química 2017, serve muito melhor este propósito. No fundo é como congelar a bactéria e as respetivas estruturas e tirar-lhes fotografias em 3D.
Prémio Nobel da Química para técnica que permite ver estruturas de biomoléculas
Agora Manuela Pereira quer “passar da fotografia ao filme”, ou seja, agora que já conhece a proteína quer ver como ela funciona. Isto pode ser feito tirando fotografias de criomicroscopia eletrónica em vários momentos do processo ou usando técnicas de microscopia com marcadores fluorescentes que permitem seguir os acontecimentos “iluminados”.
E para que serve tudo isto? “Bem, isto é investigação fundamental”, responde Manuela Pereira. Ou seja, é conhecer o funcionamento dos organismos e das suas estruturas ao pormenor. Não é um conhecimento que tenha aplicação imediata, mas conhecer melhor como é que funcionam as proteínas a temperaturas muito altas pode ter uma aplicação na indústria, por exemplo, diz a investigadora. Por outro lado, quanto mais se conhecer sobre a diversidade e adaptações das bactérias, mais vamos saber sobre as bactérias que vivem no nosso organismo e sobre as que nos causam doenças.














