Este texto foi publicado pela primeira vez em junho de 2015, altura em que se inventou o dispositivo que esta segunda-feira foi implantado num paciente português no Hospital de Santa Marta, em Lisboa.
Haskell Karp tinha 37 anos quando sofreu o primeiro ataque cardíaco, que resultou numa série de complicações de saúde ao longo dos dez anos seguintes. Em 1969 o esforço mais ínfimo, como pentear o cabelo ou lavar os dentes, causava-lhe dores insuportáveis no peito, ou uma falta de ar extrema. Segundo os critérios definidos em 1928, pela Associação Cardíaca de Nova Iorque, existiam quatro categorias de insuficiência cardíaca; a de Karp foi classificada como classe IV, a mais grave.
O cirurgião que o tratou no St Luke’s Hospital, no Texas, em 1969 era um homem enérgico chamado Denton Cooley. “O paciente tinha um coração grande e dilatado e esperávamos conseguir reduzir o tamanho do coração, para que pudesse tornar a funcionar melhor”, diz Cooley. Mas Karp não reagiu bem ao tratamento; metade do seu coração já estava de tal forma deteriorado que não havia recuperação possível. Cooley previra que isso poderia acontecer. Tinha falado sobre essa hipótese com Karp antes da operação: “Não me parece que o seu coração esteja forte o suficiente para aguentar esta cirurgia”, dissera. Mas Cooley fez uma sugestão: caso o coração de Karp estivesse demasiado fraco no final da operação, podiam pôr-lhe uma peça de substituição – um coração artificial experimental que tinham estado a desenvolver em laboratório.
O coração mecânico era uma “ponte” temporária, pensado com o objetivo de dar mais tempo a pacientes que estavam em lista de espera para receber um transplante. Tinha uma parte implantável, maior do que um coração humano, ligada a uma consola exterior do tamanho de um piano vertical que a alimentava. O aparelho conduzia ar comprimido através de duas mangueiras feitas de silicone e tecido (que entravam no corpo do paciente abaixo da caixa torácica) para as câmaras do coração artificial: uma bomba à esquerda de um lado, uma bomba à direita do outro, cada uma delas com um balão por dentro. Quando a câmara se enchia de sangue, o balão enchia-se ar e empurrava o sangue para fora, mantendo Karp vivo.
§
A necessidade de remendar corações partidos nunca foi tão grande. Só nos EUA, todos os anos morrem cerca de 610 mil pessoas de doenças cardíacas. Uma parte significativa dessas mortes podia ter sido prevenida com um transplante de coração mas, infelizmente, não há corações suficientes.
Até há relativamente pouco tempo, os médicos tinham muito poucas opções quando um coração deixava de funcionar. O primeiro marco digno de nota aconteceu em 1912, quando o cirurgião francês Théodore Tuffier usou os próprios dedos para dilatar a válvula da aorta de um doente (a válvula que ajuda a controlar o fluxo de sangue para fora de um dos lados do coração). Mas, para muitos, a história da cirurgia torácica começou em novembro de 1944, com a primeira operação a um “bebé azul” no hospital Johns Hopkins, em Baltimore, no Maryland. Na sequência de um diagnóstico feito pela sua colega Helen Tayssig, Alfred Blalock juntou a aorta (a artéria principal que sai do coração) de um bebé à sua artéria pulmonar (que leva sangue aos pulmões), dando uma segunda hipótese ao sangue de oxigenar e aliviando a falta de sangue oxigenado que fazia com que a pele daquele bebé tivesse um tom distintamente azulado.
No entanto, a possibilidade de fazer mais para reparar o interior do coração continuou inalcançável durante muitos anos; abrir o coração ditava a morte do doente em poucos minutos. Era preciso alguma coisa que travasse o fluxo do sangue para o interior das câmaras do coração, para que este pudesse ser operado, mas que fizesse com que o sangue continuasse a fluir no resto do corpo, de modo a que os órgãos vitais não fossem privados de oxigénio. Tal só aconteceria em 1954, quando foi feita a primeira cirurgia de coração aberto usando uma máquina coração-pulmões, na Jefferson Medical College, em Philadelphia.
Mesmo assim, a única solução para muitas pessoas com problemas cardíacos era – e ainda é – um transplante de um coração saudável e natural. Em 1967, o cirurgião sul-africano Christiaan Barnard fez o primeiro transplante de coração humano, na Cidade do Cabo. Foi como se alguém tivesse disparado o tiro para a partida; em breve cirurgiões no mundo inteiro começaram a fazer transplantes de coração.
O problema foi que todos esses pacientes morreram no espaço de um ano após terem sido operados. Os seus sistemas imunitários rejeitavam o tecido estranho. Para ultrapassar isto, eram-lhes dados medicamentos para suprimir o sistema imunitário. Mas, de certa maneira, estes imunossupressores eram demasiado eficazes: enfraqueciam de tal forma o sistema imunitário que os doentes acabavam por morrer com uma infeção. A medicina parecia ter voltado à estaca zero.
§
As origens do primeiro coração artificial remontam a Michael E. DeBakey, o mentor de Denton Cooley. Figura incontornável da cirurgia cardíaca norte-americana, DeBakey era conhecido como “o Tornado texano”. “Era mau como tudo”, diz Oscar Howard, ou “Bud”, Frazier, um dos muitos cirurgiões que se formou sob a orientação do Tornado. DeBakey geria o hospital como se de um campo de treino dos fuzileiros se tratasse, sendo que a maior parte dos assistentes trabalhava até 72 horas por semana, regularmente. Mas os seus padrões elevadíssimos de exigência ajudaram a estabelecer a reputação da Baylor Medical School, e as suas campanhas de angariação de fundos permitiram o arranque da investigação sobre uma série de dispositivos – incluindo o coração artificial. “Se não fosse ele, não teríamos estes dispositivos”, afirma Frazier.
A criação do campo da cirurgia artificial de coração é amplamente atribuída a DeBakey, através de uma bolsa de investigação do National Heart, Lung and Blood Institute (NHLBI, o instituto do coração, pulmões e sangue dos EUA) em 1964. O aparelho colocado em Karp em 1969 foi resultado desta investigação, mas na altura só tinha sido testado em vitelos, nenhum dos quais tinha sobrevivido mais do que umas horas. Nunca tinha sido testado em pacientes humanos. Até Haskell Karp.
Acontece que Cooley não disse a DeBakey o que estava a pensar fazer. Quando Karp foi à faca, DeBakey estava no NHLBI em Washington, a apelar a um aumento do financiamento. Sem que ele tivesse conhecimento, dois dos seus protegidos tinham estado a fazer ajustes ao coração artificial há vários meses. No seu livro “100,000 Hearts: A surgeon’s memoir” (100 mil corações, memórias de um cirurgião), Cooley conta como um colega seu, Domingo Liotta, investigador no laboratório de DeBakey, lhe apresentou um aparelho, em dezembro de 1968. Frustrado com a orientação de DeBakey, Liotta (segundo Cooley) temia que o trabalho a que estava a dedicar a vida viesse a ser descartado, uma vez que DeBakey começara a pôr em causa a possibilidade de construir um coração totalmente artificial e a interessar-se mais pela ideia de desenvolver as bombas para um dispositivo “parcial” que apoiaria o funcionamento do órgão do próprio doente.
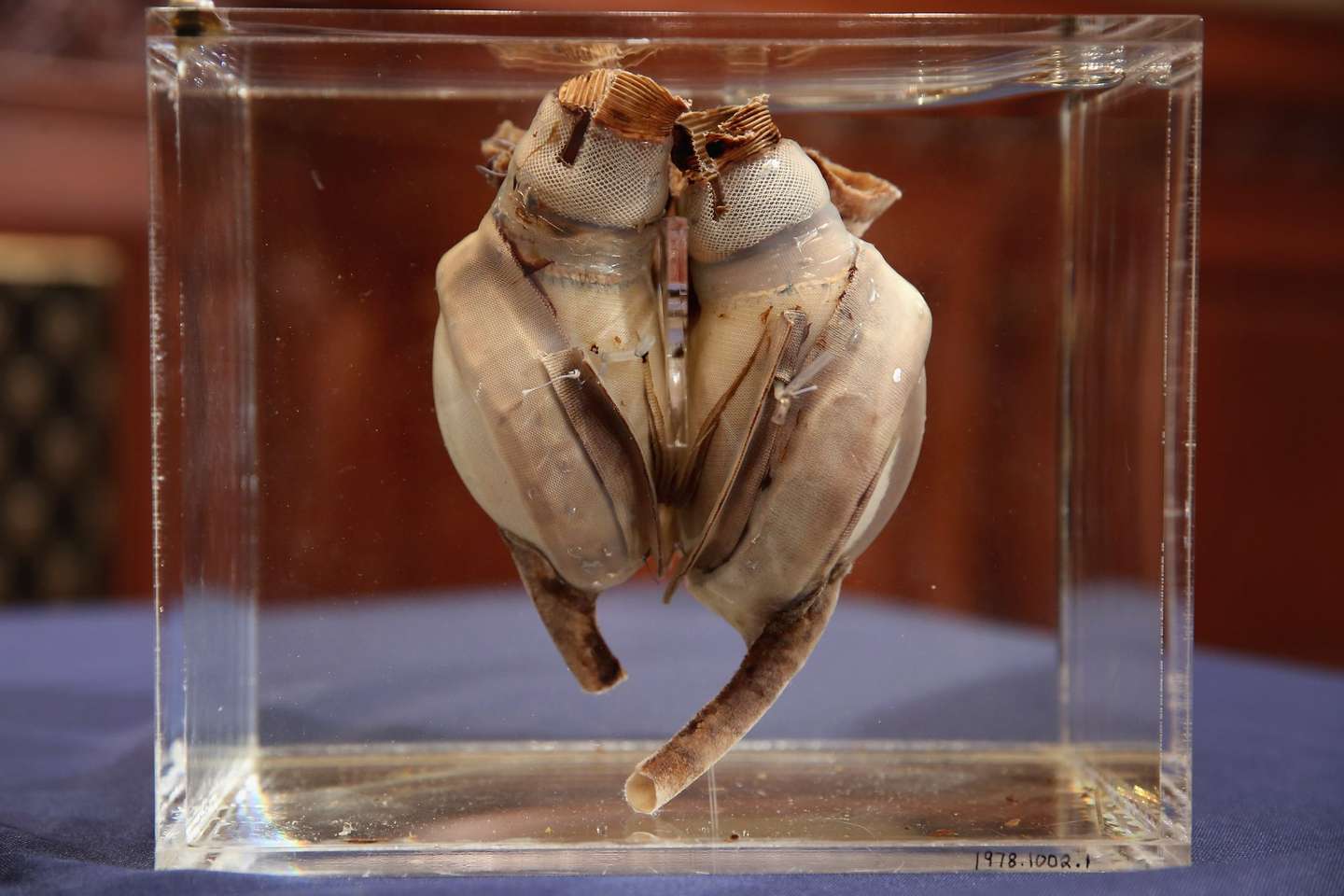
▲ Foi este o primeiro coração a ser implantado e o pomo de discórdia entre os dois cirurgiões americanos
Chip Somodevilla/Getty Images
De acordo com a versão de DeBakey, em 1969, Denton Cooley pegou no aparelho e colocou-o sem autorização, de modo a ser o primeiro médico a fazer um implante de coração artificial. Cooley e Liotta tinham alterado o desenho das válvulas e mudado o nome do dispositivo para “coração Cooley-Liotta”, pensado como uma ponte de emergência para utilizar em doentes que estavam à espera de um transplante de coração.
Cooley defendeu o seu próprio comportamento, uma e outra vez. Diz que só foi movido pela tentativa desesperada de salvar uma vida. Coisa que conseguiu, durante algum tempo.
As represálias foram graves, a nível profissional. DeBakey soube da operação através de jornalistas, que – sabendo que ele estava em Washington – foram à sua procura no hotel em que estava hospedado para obter comentários à notícia. DeBakey chamou ladrão a Cooley. Considerou que aquela operação tinha sido uma traição, um gesto infantil para reclamar uma estreia na medicina. O conflito entre os dois médicos arrastou-se ao longo de 40 anos, e foi chamado à capa da revista Time, em 1970.
Cooley defendeu o seu próprio comportamento, uma e outra vez. Diz que só foi movido pela tentativa desesperada de salvar uma vida. Coisa que conseguiu, durante algum tempo. Haskell Karp sobreviveu mais tempo do que qualquer uma das vacas que DeBakey operara – o suficiente para que fosse encontrado um dador de coração. Após 64 horas a sobreviver com a ajuda do coração artificial, Cooley fez-lhe um transplante de coração natural de um dador. Mas Karp acabou por morrer passadas 36 horas, na sequência de uma pneumonia e de insuficiência renal. Mais tarde, a mulher de Karp levou Cooley a tribunal, acusando-o de nunca lhes ter dito que o coração artificial era experimental. Cooley foi ilibado.
§
Aos setenta e quatro anos, de farta cabeleira grisalha, Bud Frazier ainda fica visivelmente emocionado ao pensar no momento em que literalmente teve a vida de um jovem nas mãos.
Corria o ano de 1965, e Frazier estava a estudar medicina. O doente tinha 18 anos e tinha um problema numa das válvulas cardíacas. Tinha sido encaminhado de Itália, onde à época não se fazia qualquer tipo de cirurgia cardiáca. Os doentes italianos eram enviados maioritariamente para os EUA, onde DeBakey ou Cooley os tratavam.
Durante a cirurgia, coordenada por DeBakey, o coração do rapaz parou de trabalhar e pediram a Frazier que pegasse nele e o massajasse, para fazer com que o sangue continuasse a circular. A certa altura, o rapaz chegou a recuperar os sentidos e olhou Frazier nos olhos. O problema foi que o coração dele não tornou a bater sozinho. Passado algum tempo, DeBakey disse a Frazier para parar: “Não o vamos conseguir salvar”, afirmou. O assistente principal concordou. Disseram ambos a Frazier para parar. Ele não quis. Se parasse, o rapaz ia morrer. Mas não serviu de nada; o coração não reagia. Frazier acabou por ter de parar.
Esta história passou-se há quase 60 anos, mas ele ainda ouve o choro da mãe cujo filho não conseguiu salvar. Essa morte inspirou um pensamento obsessivo em Frazier: “Meu Deus, se eu consigo fazer aquilo com as mãos, temos de ser capazes de construir alguma coisa que faça o mesmo.”
Depois de ter acabado o curso de medicina, Frazier combateu na Guerra do Vietname. Voltou ao Texas e à Baylor Medical School em 1971, com a intenção de trabalhar em bombas cardíacas. Mas depois do incidente com o coração artificial, DeBakey despedira Liotta e mandado toda a gente embora do laboratório. O programa das bombas chegara ao fim, mas recomeçou ali perto, no Texas Heart Institute, coordenado por Denton Cooley.
Por essa altura, Cooley era o médico que mais cirurgias cardíacas realizava no mundo inteiro. Frazier tomou a decisão difícil de sair do laboratório de DeBakey e terminar o internato do outro lado da estrada. DeBakey ficou dez anos sem lhe falar.
§
Nos meados da década de 1960, à medida que se começaram a fazer cirurgias de coração aberto em todo o mundo, os médicos do Texas Heart Institute faziam mais operações deste género do que todos os outros hospitais dos EUA juntos. Em Houston havia empresários ricos do petróleo que queriam fazer alguma coisa de importante com o seu dinheiro, e os hospitais recebiam essa filantropia de braços abertos.
“É um negócio difícil, este dos transplantes do coração”, afirma Frazier. No seu entendimento, “só lhes garantimos uma morte prematura”, embora menos prematura do que aconteceria sem operação.
Nos dias que correm, Houston é a sede do Texas Medical Center, um dos maiores centros médicos do mundo. Situado a cinco quilómetros a sul da Midtown da cidade, faz lembrar uma zona financeira, com a sua paisagem de arranha céus apontados ao céu azul, a brilhar sob o sol de Houston. No Texas Medical Center há 21 hospitais, 13 organizações de apoio, oito instituições académicas e de investigação, três faculdades de medicina, duas universidades, uma escola de medicina dentária e mais de 100 mil trabalhadores – mais do que na Apple ou na Google – numa área quase do tamanho de Gibraltar. Em 2014 foram aí realizadas mais operações ao coração do que em qualquer outra zona do planeta, muitas delas por Bud Frazier.
“É um negócio difícil, este dos transplantes do coração”, afirma Frazier. No seu entendimento, “só lhes garantimos uma morte prematura”, embora menos prematura do que aconteceria sem operação. Metade dos doentes a quem são feitos transplantes morrem no espaço de dez anos, e só cerca de 10 por cento vivem 20 anos. À porta do gabinete de Frazier está o retrato de um homem que sobreviveu 33 anos. Uma exceção.
Basicamente, o coração é um saco de músculos dividido em quatro câmaras interiores. As duas câmaras de cima chamam-se aurículas, e as duas inferiores são os ventrículos. Do lado direito, o sangue desoxigenado (com pouco oxigénio) que vem do corpo e da cabeça entra na aurícula direita, que o bombeia para baixo, em direção ao ventrículo direito. Esta câmara bombeia o sangue para os pulmões. Entretanto, do lado esquerdo, o sangue oxigenado (rico em oxigénio) vindo dos pulmões entra na aurícula esquerda, que o bombeia para o ventrículo esquerdo, e a partir daí passa para o corpo e para a cabeça. Essenciais ao funcionamento deste sistema são as quatro válvulas entre cada câmara, que mantêm o fluxo unidirecional do sangue ao fechar e impedir o fluxo inverso quando as câmaras do coração se contraem, bombeando o sangue.
Há muitas causas possíveis para a falência cardíaca. E é por isso que, como acontece com o a palavra “cancro”, é um termo usado de forma genérica para sintomas que resultam de uma série de condições: tensão alta, doença cardíaca coronária, problemas nas válvulas e fraqueza dos músculos cardíacos, que também podem ter várias causas subjacentes. Quando o coração adoece, as células que contém começam gradualmente a ficar enfraquecidas e a ceder, resultando numa perda de elasticidade do coração, como se fosse um elástico gasto na roupa interior. Fica cada vez maior. Com o aumento de tamanho, a capacidade de bombear diminui. A falência cardíaca acontece quando o coração já não consegue bombear sangue eficazmente, porque, na sua essência, é essa a sua função: trata-se de uma bomba, ainda que seja uma bomba bastante importante.
Depois de o coração Cooley-Liotta ter sido notícia, muitos cientistas começaram a trabalhar nas suas próprias versões do coração artificial. Aquele que é talvez o aparelho mais influente foi criado por Willem Kolff, o médico inventor que fabricou a primeira máquina de hemodiálise. Kolfff convidou outro engenheiro médico, Robert Jarvik, para trabalhar com ele na Universidade do Utah, e o resultado foi o Jarvik-7. Constituído por duas bombas, duas mangueiras de ar e quatro válvulas, o Jarvik-7 tinha mais do dobro do tamanho de um coração humano e só podia ser implantado em doentes grandes – sobretudo homens adultos. A consola exterior do Jarvik-7 era ligeiramente mais pequena do que a do coração Liotta-Cooley com as suas dimensões de piano. Tinha rodas, e era tão grande e pesada (embora não tão alta) como um frigorífico comum, e era ligada a fontes de ar comprimido, vácuo e eletricidade.
O seu primeiro doente foi um dentista de 61 anos chamado Barney Clark, que sobreviveu 112 dias com o Jarvik-7. Um segundo doente recebeu um implante em 1984 e morreu após 620 dias.
Em 1982, Jarvik e Koff obtiveram a aprovação da Food and Drug Administration (FDA, a agência norte-americana que regula a alimentação e os medicamentos) para usar o aparelho em pacientes humanos, tendo feito o primeiro implante nesse mesmo ano. O seu primeiro doente foi um dentista de 61 anos chamado Barney Clark, que sobreviveu 112 dias com o Jarvik-7. Um segundo doente recebeu um implante em 1984 e morreu após 620 dias. Há registo de cinco doentes a quem foi implantado o Jarvik-7 de modo permanente, tendo todos acabado por morrer no espaço de 18 meses após a cirurgia na sequência de infeções ou enfartes.

▲ Dr. Robert Jarvik mostra a diferença entre o Jarvik 7 e o novo Jarvik 2000
KAREN BLEIER/AFP/Getty Images
Nos anos que se seguiram à sua criação, o coração artificial Jarvik passou por desafios mais de natureza financeira do que médica. Em 1990, a Symbion Inc., a empresa que fabricava os implantes (inicialmente detida por Kolff e Jarvik), foi encerrada e o uso do Jarvik proibido após a Symbion ter deixado de conseguir estar à altura das exigências da FDA. Uma conjugação de esforços entre o meio académico e o empresarial – simbolizados pelo Centro Médico da Universidade de Tucson, no Arizona, e a MedForte Research Foundation, uma organização não-comercial de investigação situada em Salt Lake City, no Utah – permitiu que a tecnologia Jarvik sobrevivesse, através da compra da patente. O aparelho foi modificado e rebatizado muitas vezes desde então; na altura da escrita deste artigo [junho de 2015], era o único dispositivo artificial de substituição total do coração aprovado pela FDA utilizado como ponte-para-o-transplante.
O cirurgião que detém o recorde de maior número de cirurgias de coração artificial, assim como o de mais transplantes de coração (mas de 1100, segundo os registos mais recentes) é Bud Frazier. E o aparelho que já implantou mais vezes é um descendente direto do Jarvik-7, o SynCardia. Este dispositivo substitui os dois ventrículos do doente. O SynCardia é cosido às aurículas do doente (a parte de cima do coração) e tem duas mangueiras que atravessam a pele, ligadas a todos os sensores, motores e componentes eletrónicas que o alimentam. Estes mecanismos funcionam dentro de uma driver do tamanho de uma lancheira, transportada do lado de fora do corpo como uma mochila – embora, com seis quilos, seja bem mais pesada que uma lancheira. Na verdade, o SynCardia não é assim tão diferente do dispositivo Cooley-Liotta dos anos 1960, ou do Jarvik de 1982. “Pois, tem uns alarmes excelentes e um mecanismo melhor, mas não deixam de ser pistões a subir e a descer, com motores a empurrar e a puxar o ar”, declara Willam (Billy) Cohn, colega de Frazier.
A versão atual do SynCardia é pesada e maljeitosa, e as mangueiras que atravessam a pele implicam que o risco de infeção continua a ser elevado. “É primitivo”, diz Cohn. “Parece mesmo um daqueles brinquedos de levar para o banho.” No entanto, acrescenta, “o desenho é brilhante, porque é muito simples”, o que talvez explique ter havido tão poucas modificações no desenho em mais de 25 anos. E é eficaz o suficiente para permitir que os doentes voltem a ter estilos de vida ativos – uma vez que o aparelho pode ser transportado numa mochila, alguns pacientes até jogam ténis ou andam de bicicleta.
É eficaz o suficiente para permitir que os doentes voltem a ter estilos de vida ativos – uma vez que o aparelho pode ser transportado numa mochila, alguns pacientes até jogam ténis ou andam de bicicleta.
O maior desafio para Frazier e Cohn é o facto de o aparelho ter uma duração limitada. O modelo atual do SynCardia custa cerca de 100 mil dólares e tem de ser substituído de três em três meses, uma vez que os componentes internos, que segundo Cohn batem cerca de 120 mil vezes por dia, acabam por se gastar. E assim sendo, tal como os sues antecessores Jarvik e Cooley-Liotta, este aparelho só é realmente útil como “ponte”, para manter os doentes vivos até que possam receber um transplante de coração.
Além do mais – como me diz Frazier, enquanto Conh concorda, acenando com a cabeça – os doentes que já tenham sido sujeitos a um transplante não se dão bem com estes dispositivos, porque o coração como um todo falha. A única coisa que pode ajudar nesses casos é um coração completamente novo. “Temos um doente agora que tem um coração pneumático”, revela Frazier. “É um jovem. Tratei dele quando tinha 20 anos e rejeitou o coração quando chegou aos 30. Pusemos-lhe um SynCardia e ele tem-no há uns três anos. Mas vai falhar. Já dá para perceber que está a falhar, mas também não lhe podemos fazer um transplante, porque tem demasiados anticorpos [que rejeitariam um coração novo], e de qualquer forma não conseguiríamos encontrar um dador.”
“Não funciona bem”, suspira. “Mas é melhor que morrer”, acrescenta Cohn.
O SynCardia não é uma solução a longo prazo para o falhanço cardíaco. O mesmo se pode dizer em relação a muitas alternativas. No início da década de 2000, a Abiomed, uma empresa sedeada no Massachusetts, apresentou um coração novo que (ao contrário do SynCardia) foi desenhado para ser permanente – um substituto completo do coração para doentes terminais de insuficiência cardíaca que não são candidatos para transplante e que não podem ser ajudados por nenhum dos outros tratamentos disponíveis.
O AbioCor da Abiomed tinha uma bateria implantada internamente, recarregada de forma contínua por uma consola externa ou por uma mochila com uma bateria básica que o doente transportava. Assim, não havia tubos nem fios a perfurar a pele, o que fazia com que os riscos de contrair uma infeção diminuíssem.
Foram implantados dispositivos AbioCor em 15 doentes humanos – cinco deles às mãos de Frazier, no Texas Heart Institute. Ainda assim, o doente que sobreviveu mais tempo após a operação aguentou menos de um ano e meio antes de o aparelho se estragar. A maior parte dos doentes resistiu cinco a nove meses. O aparelho – do tamanho de uma meloa –, tal como os seus antecessores, continuava a ser demasiado grande e difícil de implantar. O último implante de AbioCor foi feito em 2009. Mais uma vez, parecia que a medicina voltava a estaca zero.
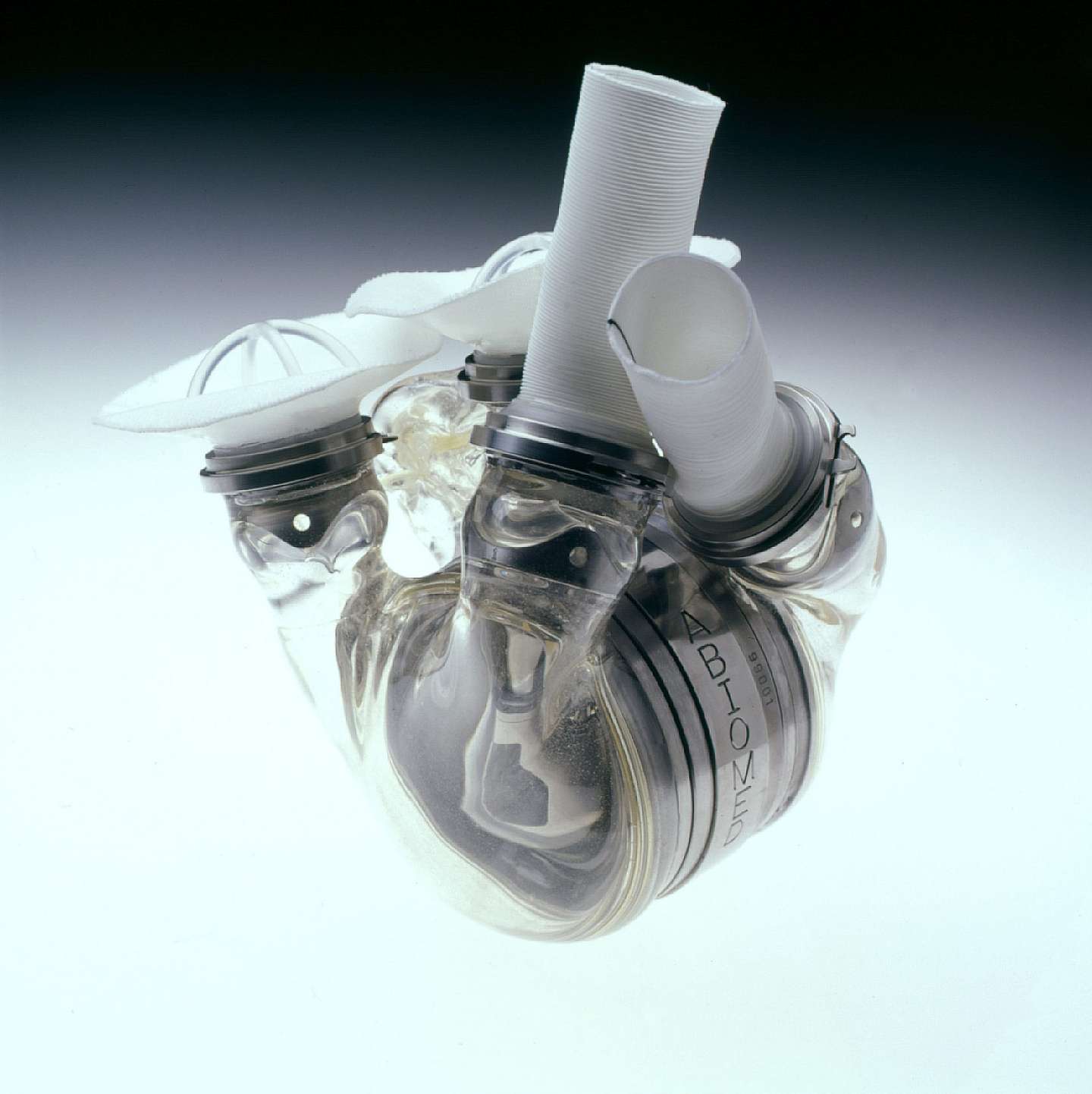
▲ Este é o AbioCor da Abiomed
Getty Images
Mas talvez isso não tenha sido mau de todo. Todas estas versões de dispositivos cardíacos artificiais, quer o seu objetivo seja apoiar o coração ou substituí-lo por inteiro, tentavam copiar o funcionamento do coração, imitando o fluxo natural do sangue. O SynCardia, o AbioCor, o Jarvik, mesmo o primitivo Cooley-Liotta, enchiam-se de sangue e depois despejavam-nos à força para o corpo. O resultado é aquilo a que se chama uma bomba pulsátil, sendo que o fluxo sanguíneo entra no sangue como se viesse de um coração natural, a uma média de 80 esguichos por minuto, os imprescindíveis para manter a vida. É essa a razão de ser do movimento suave que se sente ao pousar os dedos no pulso ou no peito – é a nossa pulsação, que corresponde ao batimento do nosso coração.
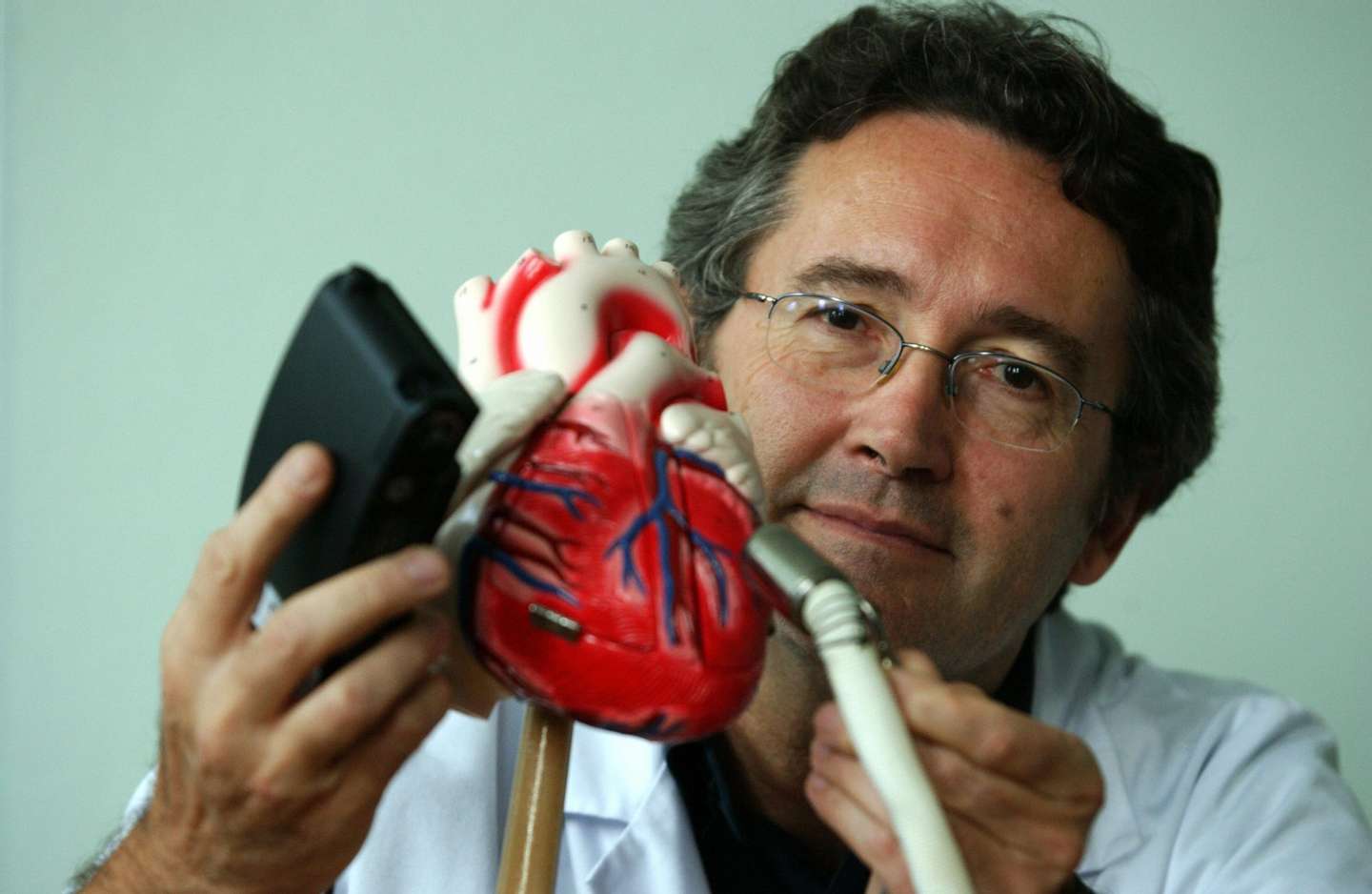
▲ Gilles Grollier, chefe do Departamento de Cardiologia do Hospital de Caen, França, mostra o Jarvik 2000
MYCHELE DANIAU/AFP/Getty Images
Hoje em dia, Frazier, Cohn e o Texas Heart Institute estão a trabalhar numa nova geração de corações artificiais que são diferentes de todos os seus antecessores num aspeto fundamental: não batem.
§
O parafuso de Arquimedes era um mecanismo antigo usado para puxar água no sentido contrário à gravidade. Como o próprio nome indica, a invenção deste aparelho do século III é atribuída ao matemático grego Arquimedes. Basicamente, trata-se de um parafuso dentro de um cilindro vazio; ao colocar a ponta de baixo do cilindro dentro de água e rodá-lo, a água que se encontra a um nível inferior sobe. O aparelho foi criado com o intuito de drenar a água das minas e de outras zonas inundadas. Em 1976, ao participar numa missão de voluntariado médico no Egito, o cardiologista Richard K. Wampler viu dois homens a utilizar um mecanismo desses para bombear água por um rio acima. Ficou inspirado. Talvez se possa aplicar o mesmo princípio para bombear sangue, pensou.
Daí resultou a Hemopump, um aparelho do tamanho da borracha de um lápis. Quando o parafuso dentro da bomba rodava, o sangue era bombeado do coração para o resto do corpo. Na altura não havia motores suficientemente pequenos para caber dentro de um dispositivo implantável, por isso Wampler concebeu um desenho em que o motor ficava do lado de fora, na perna do doente, ligado por um cabo da artéria na perna do doente à bomba. Como seria de esperar, o primeiro médico a implantar este dispositivo – primeiro numa vaca, e depois num paciente – foi Bud Frazier, em abril de 1988.
A Hemopump foi a primeira bomba de “fluxo contínuo” do mundo. As turbinas que giram rapidamente criam um fluxo semelhante ao da água a subir por uma mangueira do jardim, o que significa que o fluxo sanguíneo é contínuo, de um momento para outro momento. Isto significa que o sangue não é despejado em esguichos. Não há “pulsação”. O coração do doente continua a bater, mas o fluxo contínuo proveniente do dispositivo esconde a sua pulsação natural, o que faz com que muitas vezes o batimento cardíaco não seja detetável no pulso ou no pescoço.
Tratava-se de um dispositivo temporário, que só podia ser utilizado enquanto o doente estivesse deitado de barriga para cima na cama. A Hemopump não foi pensada como substituto do coração; a sua função principal era facilitar a tarefa do coração para que este pudesse descansar. Como se fosse uma espécie de cadeira de rodas para o coração, destinava-se a ajudar os doentes a recuperar. Mas, mesmo assim, a Hemopump teve os seus problemas. Uma vez que implicava a inserção um tubo através da artéria femoral, tubo esse que era depois manipulado até passar por cima da válvula da aorta, em 20 por cento dos casos a bomba não podia ser utilizada, por o tubo ser demasiado grande. Para além disso, na altura não existiam motores suficientemente potentes para que as turbinas girassem à velocidade necessária, e nos primeiros estudos o cabo também se partia. A certa altura, o financiamento começou a escassear, e no início da década de 1990 a Hemopump tinha caído em desuso.
Mas a sua presença continua a fazer-se sentir. O último protótipo de coração da Abiomed, o Impella, recorre a tecnologia semelhante, apoiada pelos mais recentes saltos na evolução da engenharia moderna. Tem um motor tão pequeno que cabe na parte de dentro do aparelho, na ponta do cateter, em vez de ficar do lado de fora do corpo. O Impella é a bomba cardíaca mais pequena a ser utilizada atualmente – não é muito maior do que um lápis – e foi aprovada pela FDA em março de 2015 para uso clínico, apoiando o funcionamento do coração até seis horas durante cirurgias cardíacas. Entretanto, no Texas Heart Institute, Frazier e Cohn – inspirados por Wampler – têm estado a trabalhar na sua versão do parafuso de Arquimedes. O HeartMate II, à semelhança da Hemopump, não substitui o coração, funcionando antes como uma espécie de muletas.
Com um tamanho semelhante ao de um abacate pequeno, o HeartMate pode ser utilizado em doentes com sintomas mais alargados do que o SynCadria e, em teoria, tem uma esperança de vida mais longa – até dez anos. A chave é a tecnologia do parafuso: a turbina giratória cria menos fricção do que os aparelhos cardíacos pulsáteis, o que reduz o desgaste. Desde que foi aprovada pela FDA em 2010, cerca de 20 mil pessoas – incluindo Dick Ceheney, ex-Vice Presidente dos EUA – receberam um HeartMate II, vinte das quais usam o aparelho há mais de oito anos. E com uma pulsação praticamente indetetável.
Desde que foi aprovada pela FDA em 2010, cerca de 20 mil pessoas – incluindo Dick Ceheney, ex-Vice Presidente dos EUA – receberam um HeartMate II, vinte das quais usam o aparelho há mais de oito anos.
Os estudos em animais para a próxima encarnação do dispositivo já estão em curso. O HeartMate III [o dispositivo que foi implantado no doente português em Santa Marta] foi reduzido ao tamanho de um ioiô, e a parte que roda usa tecnologia de levitação magnética – semelhante à dos comboios Maglev da China, Alemanha e Japão, os mais rápidos do mundo. “Como não tem membranas nem válvulas flexíveis, nem rolamentos mecânicos, não vai haver problemas de desgaste mecânico”, afirma Cohn.
A 20 de janeiro de 2015, numa operação que durou mais de oito horas, vi o coração de uma vitela chamada Chicle (a palavra espanhola que quer dizer pastilha elástica, por ter passado a noite a mastigar) a ser substituído por dois dispositivos HeartMate III. A Chicle, tal como os 75 vitelos que a antecederam, é uma das cobaias das experiências que Frazier e Cohn estão a levar a cabo no Texas Heart Institute. O objetivo é perceber até que ponto o corpo tolera uma circulação completamente desprovida de batimentos cardíacos; “tentar perceber o que a Mãe Natureza está pronta a suportar”, explica Cohn.
No dia seguinte fui com o cirurgião que operara Chicle, Cohn, para ver como ela estava. Estava calma e não tinha parado de mastigar, aparentemente feliz, e viva, embora sem pulsação.
§
Antes de o HeartMate III ser testado em seres humanos, a geração seguinte de corações artificiais sem pulsações já está a caminho. Batizada BiVACOR (um “Dispositivo de Apoio Biventricular” rotativo), também recorre à tecnologia de levitação magnética. A diferença fundamental, segundo Cohn, é que ao contrário dos aparelhos anteriores, este foi pensado como um coração de substituição total – que, pelo menos em teoria, pode durar para sempre.
Nos testes iniciais o BiVACOR mostrou ter uma grande eficiência energética, comparado com os aparelhos anteriores de coração artificial. Uma vez que requer menos energia elétrica para trabalhar, tem o potencial de funcionar por períodos mais alargados através de baterias internas, diz Cohn. A versão atual usa cerca de 10 watts com baterias internas que o podem alimentar durante duas a três horas, na eventualidade de haver algum problema com a ligação à bateria, que é utilizada num colete à volta do corpo. O objetivo último é conseguir criar um sistema sem fios e alimentar o dispositivo através da pele recorrendo ao emparelhamento indutivo, o princípio de campos magnéticos que é utilizado para carregar as escovas de dentes elétricas. Cohn imagina uma bobina de cada lado da pele: eliminando a necessidade de recorrer a fios, um campo magnético oscilante a dar conta da alimentação. Isto também poderia querer dizer que não haveria perfurações da pele, e dessa forma – tal como acontecia com o pioneiro AbioCor – reduzir-se-ia o risco de infeção.
O BiVACOR foi uma criação de Daniel Timms, um engenheiro australiano que começou por esboçar a sua ideia há cerca de quinze anos. Um encontro fortuito numa conferência em Singapura chamou atenção dos investigadores do Texas Heart Institute para o trabalho dele. Quando Frazier e Cohn viram a sua ideia em setembro de 2011, consideraram que era o plano mais evoluído e brilhante para um coração artificial de que tinham tido conhecimento até à data. No espaço de uma semana, ajudaram Timms a angariar cerca de 2 milhões e meio de dólares, que logo criou uma empresa (também chamada BiVACOR) e levou toda a sua equipa para os laboratórios do Texas Heart Institute para fazer investigação e experiências.
Cohn diz que é muitas vezes censurado pela sua confiança absoluta no BiVACOR e pelas afirmações que tem feito no sentido de que o dispositivo pode “durar para sempre”. Mostra-me uma caixa com uma centenas de protótipos impressos em 3D do rotor do BiVACOR, com formas subtilmente diferentes entre si. A equipa está constantemente a fazer experiências, utilizando uma solução de 40 por cento de glicerina para imitar o sangue. Já desenvolveram rotores que funcionam extremamente bem, mas acreditam que ainda têm espaço para melhorar o desenho. Neste momento, estão prestes a começar a realizar estudos em animais no final de 2016 e, se forem bem sucedidos, poderão começar a fazer estudos com humanos já em 2019.
Tento imaginar um mundo povoado por pessoas sem pulsação. Nesse futuro, como é que poderíamos saber se uma pessoa estava viva? “É muito fácil”, assevera Cohn, acabando rapidamente com a minha fantasia filosófica existencialista. “Quando beliscamos o polegar e passa de cor de rosa a branco e volta imediatamente a cor de rosa, é sinal de que o sangue está a circular no corpo. Também se pode ver que uma pessoa está viva se estiver a respirar.”
Ainda assim, admite que quando houver dispositivos destes a ser implantados sistematicamente em doentes cardíacos possa vir a ser preciso conceber um método padrão para determinar os sinais de vida dessas pessoas. Cohn imagina que possam vir a usar pulseiras, ou até a fazer tatuagens que avisem as outras pessoas do facto de não terem pulsação.
“Qualquer procedimento novo que surja vai ter detratores”, diz o mentor de Frazier, o incansável Denton Cooley. “No dia em que o Christiaan Barnard fez o primeiro transplante, os críticos fizeram-se ouvir tanto ou mais do que os defensores dos transplantes artificiais de coração”, assevera. “Há uma certa dose de mistério associada ao coração e à sua função. Mas creio que a maior parte dos críticos eram ignorantes, estavam mal informados ou eram simplesmente supersticiosos.”
Cooley fez o primeiro transplante de coração nos EUA em maio de 1968. E, com 94 anos, continua a acarinhar a memória do dia em que implantou o primeiro coração artificial no peito de Haskell Karp e a “satisfação que foi ver o coração a manter aquele homem vivo”.
“Sempre pensei que o coração só tem uma função, que é bombear sangue”, diz. “Nesse aspeto, é um órgão muito simples.”
Texto: Alex O’Brien
Editor: Mun-Keat Looi
Fact checker: Francine Almash
Copyeditor: Kirsty Strawbridge
Tradução: Francisca Cortesão