Lavar as mãos é um gesto simples, ensinado às crianças mesmo antes de entrarem para a escola, mas que continua a ser esquecido por muitas pessoas, incluindo os profissionais de saúde. Lavar as mãos antes e depois de se examinar cada doente é tão ou mais importante do que limpar as casas de banho para evitar a disseminação de bactérias, em particular aquelas que são resistentes aos antibióticos mais potentes.
Melhorar a higiene de cuidadores e doentes e melhorar a limpeza do espaço fazem parte das estratégias para controlo das infeções. Outras estratégias passam pela redução do número de intervenções invasivas e da duração dessas intervenções, disse Carlos Palos, médico no Hospital Beatriz Ângelo, em Loures. O médico referiu-se, por exemplo, à algaliação (colocação de uma sonda na uretra), aos cateteres endovenosos e, até, ao corte dos pelos antes das cirurgias.
Uma utilização consciente dos antibióticos, com a recomendação de toma apenas quando é necessário, com a duração mais curta possível e com uma atuação mais específica para determinada infeção, é outra das recomendações do coordenador do Programa de Prevenção e Controlo de Infeções e de Resistência aos Antimicrobianos (PPCIRA) do grupo Luz Saúde.
Remember: ALWAYS wash your hands to prevent infections (and avoid the need for #antibiotics). Let's stop the spread of #AntibioticResistance! pic.twitter.com/5gkgl2LaLu
— World Health Organization (WHO) (@WHO) November 16, 2017
Enquanto representante do PPCIRA para a Direção-Geral de Saúde, Carlos Palos esteve em Bruxelas na celebração do décimo aniversário do Dia Europeu dos Antibióticos. Ao Observador falou do problema que Portugal ainda tem com as bactérias resistentes e da dificuldade que tem existido em implementar equipas de controlo de infeção e programas de apoio à prescrição dos antibióticos nos hospitais.
O relatório sobre a resistência a antibióticos divulgado esta quarta-feira pelo Centro Europeu de Controlo e Prevenção da Doença [ECDC, na sigla em inglês] não mostra uma situação muito favorável para Portugal [a frequência de bactérias resistentes aos antibióticos das últimas linhas é muito alta]. O que andamos a fazer de errado e como chegámos a este ponto?
Temos que considerar que existem alguns números mais favoráveis para Portugal e alguns menos favoráveis. Algumas bactérias, como a MRSA [Staphylococcus aureus resistentes a meticilina] ou a Acinetobacter baumannii estão em melhoria. A MRSA continua no mapa a vermelho, mas, na verdade, temos dados que mostram que há uma diminuição [da percentagem de casos resistentes], mas que não permitem ainda a mudança de cor. E temos um problema com a bactéria Klebsiella [pneumoniae] resistente aos carbapenemos, que está a aumentar a incidência. É, no fim de contas, uma continuação do que está a acontecer nos países do sul da Europa e da Europa de Leste, onde a taxa é bastante elevada. Tínhamos uma taxa mais baixa, mas estamos efetivamente a subir.
Não podemos entender que é tudo negativo, estamos a melhorar nalguns aspetos, mas temos este grande desafio pela frente.
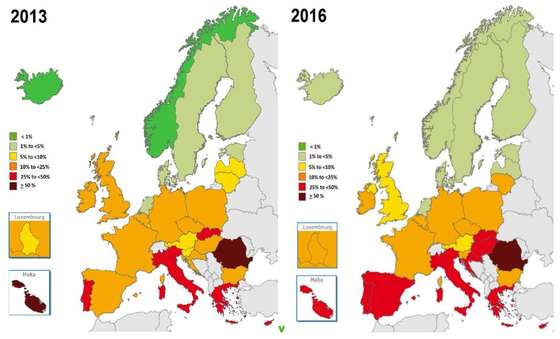
Percentagem da bactéria Staphylococcus aureus resistentes a meticilina (MRSA, na sigla em inglês) no total das infeções de Staphylococcus aureus em cada país – EARS-Net/ECDC
O que estão a fazer para alterar a situação?
Estamos, desde há um ano, a trabalhar ativamente em novas práticas de abordagem aos doentes quando são admitidos nos hospitais, incluindo o rastreio para estas bactérias. Quando as pessoas estão colonizadas — não têm a doença, mas têm a bactéria — e entram no circuito hospitalar, se não forem detetadas e não forem isoladas, facilmente se transmite a bactéria de uns doentes para os outros. Alguns deles, pela sua suscetibilidade [podem ser facilmente infetadas], podem efetivamente ficar doentes e, se ficarem doentes, estas infeções podem ter gravidade.
Isso já está a ser implementado em todos os hospitais em Portugal?
Há uma recomendação da DGS [Direção-Geral de Saúde], que tem alguns meses, para que todos os hospitais portugueses tenham em conta este rastreio, como já se fazia para a MRSA. Este rastreio é feito através da aplicação de uma espécie de cotonetes no nariz e a nível retal.
Ainda nem todos os hospitais o estão a fazer, vão introduzindo progressivamente. Alguns hospitais já estão a utilizar uma metodologia rápida, que lhes permite perceber em poucas horas se o doente está ou não colonizado, em vez de recorrer à microbiologia convencional, que só ao fim de dois dias permite ter essa informação. De qualquer maneira, não importa só saber se os doentes estão ou não colonizados, importa também tomar medidas para que os doentes que são considerados doentes de risco sejam postos de imediato em isolamento. O isolamento, mesmo antes de se saber se estão ou não colonizados, evita a transmissão para os outros doentes.
As pessoas que estão colonizadas — que são portadores da bactéria — podem ser colocadas em isolamento para evitar a contaminação de outros doentes no hospital, mas não têm necessariamente de receber nenhum tratamento específico para essa bactéria, correto?
Exatamente. Nós somos bactérias. As bactérias estão na pele, estão no nariz e estão acima de tudo nos nossos intestinos. E nós vivemos com elas. Quando tomamos um antibiótico estamos a perturbar um equilíbrio normal, algumas dessas bactérias tornam-se resistentes aos antibióticos e as mais sensíveis morrem. Em termos práticos, podemos ter [ser portadores de] bactérias resistentes, mas não ter a doença, e por isso não devemos ser tratados. Quando damos antibióticos para supostamente tratar estas situações, que se chamam colonizações, estamos verdadeiramente a agravar o problema e a induzir novas resistências.
O antibiótico vai perturbar o equilíbrio das bactérias que existe no nosso corpo. Mas devemos tomar antibióticos quando esse equilíbrio foi perturbado pelas bactérias que lá existem?
Temos que tomar antibióticos quando temos uma infeção, ou seja, quando as bactérias nos estão a provocar uma doença.
Podem ser as bactérias que existem no nosso organismo a desequilibrarem-se por si só a e a desenvolverem-se mais?
Sim. A questão principal é que temos todos de utilizar antibióticos de forma correta. Por isso, o lema deste ano do Dia Europeu dos Antibióticos [que se celebra a 18 de novembro] é “Antibióticos: use-os com cuidado” — em inglês “Handle with care”. Todos nós, desde os cidadãos até aos profissionais de saúde temos de utilizar os antibióticos com cuidado.
Os profissionais de saúde, os médicos que prescrevem os antibióticos, têm de ter em atenção que nem todas as infeções precisam de antibióticos, que os antibióticos têm de ser usados pelo menor tempo possível (o tempo adequado) e com o menor espectro [de ação] possível – não utilizar antibióticos que cubram todas as bactérias, mas antibióticos dirigidos às bactérias que mais provavelmente estão a causar a doença.
Por outro lado, os farmacêuticos, a nível hospitalar, podem ajudar os médicos, por exemplo, informando-os de algumas interações, de alguns efeitos secundários, ou até da chegada de novos resultados microbiológicos. Ou, ao fim de três dias de tratamento, alertar os médicos que alguns antibióticos podem passar a ser administrados por via oral — tomando comprimidos — em vez de ser por via endovenosa [diretamente na corrente sanguínea]. Com isto conseguimos retirar os cateteres mais cedo e conseguimos reduzir o número de dias de internamento, que é importante para prevenir infeções.
Os enfermeiros também têm um papel importante, porque podem informar os médicos da existência de efeitos secundários relacionados com a administração do antibiótico e também podem lembrar os médicos que ao fim de três dias pode ser possível passar alguns antibióticos para comprimidos.
A nível dos cidadãos, todos temos de ter a noção que os antibióticos não servem para tratar a febre, não servem para tratar as dores musculares, não servem quando estamos constipados ou com gripe. Para isso temos outros medicamentos, como o paracetamol. Temos de ter alguma paciência: se não pertencermos a nenhum grupo de risco devemos esperar quatro ou cinco dias — tal como fazemos com as crianças — e, provavelmente, a febre, as dores de cabeça ou as dores musculares vão passar por si, porque são causadas por vírus. E os antibióticos não tratam vírus.
Acha que o ideal era que se soubesse exatamente qual a bactéria que causou a infeção para se recomendar o antibiótico mais indicado?
Até antes disso. Quando um médico está perante um doente que tem determinados sintomas, tem de perceber se é uma infeção bacteriana ou se é uma infeção viral. E nem sempre é fácil. Pode ser fácil nos hospitais onde existem análises, como a análise da proteína C reativa [PCR] que é um marcador de probabilidade de infeção por uma bactéria.
Nos cuidados de saúde primários, como os consultórios, não há meios [de diagnóstico] complementares. Mas podia haver. Hoje em dia há tecnologias chamadas de “point of care” — tecnologias no ponto de realização — e deveria ser um desígnio nacional disponibilizar essas tecnologias de PCR “point of care” nos centros de saúde e consultórios, tal como a Inglaterra, os países nórdicos e até países de leste estão neste momento a fazer. Uma picada no dedo, que ao fim de três minutos tem a resposta, permite aos médicos no ambulatório tomar uma decisão, com maior consciência, sobre se é uma infeção bacteriana ou viral. E também permite que o próprio doente se sinta mais seguro e que não pressione o médico para que prescreva um antibiótico.
Primeiro é isso: é uma infeção bacteriana ou não é. E agora respondendo à sua pergunta. Sim, se tenho uma infeção bacteriana, tenho de ter métodos rápidos que me digam qual é a bactéria. Efetivamente existem métodos muito rápidos que ao fim de seis horas nos dão a bactéria em questão ou que nos dão, não a bactéria, mas qual o mecanismo de resistência. Em termos de tratamento é muito mais importante. Posso não saber qual é a bactéria exatamente, mas se sei que aquela bactéria é resistente àquele antibiótico, não o devo dar. Estes métodos, são métodos extremamente caros, não se podem generalizar a todas as situações, mas podem, por exemplo, ser muito úteis nos doentes que estão internados nos cuidados intensivos, porque quanto melhor for o antibiótico que damos, maior a probabilidade de sucesso.
Como forma intermédia, temos métodos que nos dão, de uma forma generalizada nos hospitais, ao fim de seis horas, qual a bactéria — mas não sabemos qual é exatamente o mecanismo de resistência. Isto também permite atuar logo com determinado antibiótico e não com outro. E temos também a microbiologia convencional, que são as culturas microbiológicas, que normalmente dão um resultado ao fim de 48 horas [sobre qual a bactéria].
Sem saber qual é a bactéria, como é que o médico decide qual o antibiótico?
Quando um médico prescreve um antibiótico, baseia-se na probabilidade do agente que está causar a infeção. Se é uma infeção da comunidade [como nos lares] ou se é uma infeção hospitalar, se a pessoa já tomou antibióticos antes ou não, quais os últimos resultados das análises de microbiologia (se existirem), se é uma pessoa com uma doença como diabetes, se é uma pessoa que tem feito muitos antibióticos. Portanto há um conjunto de fatores que faz modificar a prescrição.
Este ano, o ECDC reformulou a checklist de prescrição dos antibióticos e é fundamental que cada médico, quando faz a sua prescrição, siga um raciocínio muito rápido e pense, em primeiro lugar, se aquilo é uma infeção bacteriana, se é uma infeção viral ou se é uma colonização. Se for viral ou uma colonização não vale a pena dar antibiótico. Esta checklist tem de entrar na prática clínica, quer a nível dos hospitais, quer a nível dos consultórios médicos, porque pode continuar a marcar a diferença entre não prescrever tão bem e prescrever melhor.
Uma outra questão tem a ver com a duração da toma. Geralmente, quando vamos ao médico de clínica geral, a prescrição de um antibiótico é sempre “a caixa até ao fim”. Este é sempre o tempo recomendado ou devia ser avaliado caso a caso?
Deve ser avaliado essencialmente pelo tipo de infeção. Há infeções, como por exemplo as infeções urinárias nas jovens saudáveis — que não têm infeções urinárias de repetição e que não têm outras complicações de saúde — que se tratam com uma única administração de um único antibiótico. Toma única. Outras situações podem exigir durações diferentes. De modo geral não se devem exceder os sete dias de antibiótico, esta é uma regra mesmo para doentes internados no hospital. Claro que há situações de exceção e há infeções que nos obrigam a tratamentos prolongados durante meses, como a infeção do osso (osteomielite).
Países como os Estados Unidos têm a prescrição personalizada, ou seja, o médico diz, não só qual é o medicamento, como também quantos comprimidos. Em Portugal e na Europa isso não é prática comum. As embalagens estão formatadas para um determinado número de comprimidos. O que tem de haver é um melhor ajuste das embalagens para o ciclo de tratamento. Há que repensar e aperfeiçoar um pouco este aspeto. É um desafio para a industria farmacêutica, sem dúvida.
Falando das infeções, referiu que uma toma única pode ser suficiente para tratar a infeção. Mas em muitos casos, são utilizados antibióticos de largo espetro que acabam por trazer mais problemas que vantagens.
Pois, temos de fazer um esforço de melhoria da prescrição por parte dos médicos. O desafio é, por um lado, ter a certeza que estamos a atuar sobre as bactérias certas, e, por outro lado, usar o menos tempo possível os antibióticos. Utilizar antibióticos de largo espectro, como os da classe das quinolonas, e por tempos demasiado prolongados, é uma causa da indução de resistência que hoje nós temos.
No caso das quinolonas, não vale a pena usá-las como primeira linha. Primeiro, porque não estão nas recomendações nacionais nem internacionais. Outro motivo para não serem utilizadas é que pelo menos um terço das bactérias que causam as infeções urinárias são da espécie Escherichia coli, resistente às quinolonas. As quinolonas são pura e simplesmente para não utilizar, a não ser em situações de alergia aos beta-lactanos (derivados da penicilina) ou em situações em que evidentemente temos uma resistência a outros antibióticos e não a este.
#AntibioticResistance occurs everywhere in the world, in both rich and poor countries. It can affect anyone, of any age. Learn how it spreads.
Let’s #StopSuperbugs! pic.twitter.com/oI4mPgcJ7x— World Health Organization (WHO) (@WHO) November 15, 2017
Este mau uso dos antibióticos é o que justifica o aumento das bactérias multirresistentes?
A resposta é sim. Mas temos que pensar que os antibióticos não são só usados em humanos. E aqui entramos num outro aspeto, ao qual agora se dá muita importância, que é considerar a saúde como uma saúde global (“one health”). Neste conceito, consideram-se os animais de criação. Em muitos países, e apesar de ser proibido, estes animais são engordados com antibióticos, porque os antibióticos funcionam também como estimulantes de crescimento. Esses animais através das suas fezes e urina contaminam os solos, que contaminam as águas que acabamos por beber.
Temos o mundo cheio de antibióticos. Algumas pessoas nunca tomaram antibióticos e já têm as bactérias resistentes aos antibióticos.
Depois temos um outro aspeto, ganharmos bactérias de outras pessoas — transmissão cruzada. E a transmissão cruzada pode acontecer em qualquer lado, mas acontece essencialmente quando estamos debilitados e quando estamos confinados a espaços, tais como hospitais, lares e residências, onde a transmissão das bactérias pelos cuidadores, pelos profissionais, pelo equipamento, é uma realidade, se não forem tomadas as medidas adequadas, como lavar as mãos. A higiene das mãos dos cuidadores e dos pacientes e a limpeza ambiental são muito importantes. A limpeza adequada das casas de banho, dos pontos de toque das pessoas, são aspetos que por vezes são descurados ou que não têm um cuidado tão grande, quer a nível hospitalar, quer a nível do ambiente extra-hospitalar.
Esta contaminação cruzada também pode acontecer nas casas das pessoas, sem isso significar que haja uma infeção.
Somos parte de um sistema onde vivemos. As nossas bactérias são partilhadas com o nosso ambiente e com as outras pessoas e, para quem tem animais, também com os animais. A questão aqui é que tirando algumas bactérias que provocam doenças importantes, como o Clostridium difficile, que causa diarreias, as outras pessoas, se forem saudáveis, não ficam doentes. Se tiver em casa uma pessoa colonizada com uma destas bactérias, que seja portadora de uma destas bactérias, não significa um perigo para as outras pessoas da casa. As pessoas têm de ter o seu comportamento normal. Quanto mais tempo passa desde que as pessoas voltaram do hospital para o seu ambiente normal, maior a possibilidade de elas ficarem com as bactérias normais [daquele ambiente]. Temos de desmistificar: tirando as situações em que as pessoas têm uma doença que as torna muito suscetíveis, como no tratamento de um tumor ou outra imunodepressão, as outras pessoas podem conviver sem qualquer problema.
Uma pessoa pode estar colonizada com uma bactéria multirresistente toda a vida sem nunca ter uma infeção com essa bactéria?
Afirmativo. Normalmente só acontece uma infeção por uma de duas razões. Ou porque, por qualquer razão, a pessoa fica mais vulnerável e a bactéria toma conta da situação, o nosso microbioma [comunidade de microorganismos que vive no nosso corpo] desequilibra-se e a bactéria começa a ganhar às outras e, aí, causa doença. Ou quando nós fazemos procedimentos como espetar agulhas, pôr tubos para ventilar, algaliar os doentes — que é uma coisa que se faz em excesso —, significa que as bactérias que estavam a colonizar-nos sossegadinhas de repente introduzimo-las dentro do nosso corpo, porque ultrapassámos as barreiras naturais de defesa.
Falando em barreiras de defesa e aproveitando o caso da algaliação, há uma série de procedimentos que agora não se recomendam, como rapar os pelos antes das cirurgias, que era um procedimento comum. Porquê estas alterações?
Por causa de um grupo de infeções, as infeções associadas aos cuidados de saúde. As infeções urinárias associadas à algaliação [colocação de sonda pela uretra até à bexiga] é o tipo de infeção [associada aos cuidados de saúde] mais frequente. Porquê? Porque algaliamos muito os nossos doentes. Há pessoas que são algaliadas logo nas urgências e que não deveriam ser. Passa por uma mudança de mentalidade de médicos e enfermeiros para que, por exemplo, as pessoas idosas que vêm dos lares não sejam todas algaliadas. Não é preciso. Não devemos fazê-lo. O objetivo principal da algaliação deve ser manter permeável a via urinária, não é saber quanto a pessoa urina. Existem critérios muito bem definidos para algaliar os doentes. Se o doente não preencher esses critérios não deve ser algaliado. E se for, devem ser desalgaliados o mais depressa possível. A nível internacional e no meu hospital desenvolvemos um protocolo de desalgaliação autónoma pelos enfermeiros — que desalgalia o doente com base numa checklist que é verificada diariamente. E isso reduz de forma significativa o número de dias de algaliação e reduz a taxa de infeção urinária associada.
A segunda infeção mais frequente associada aos cuidados de saúde é a infeção respiratória, nomeadamente associada à ventilação nos cuidados intensivos [com um tubo na traqueia]. Há um conjunto de boas práticas que têm, por exemplo, a ver com a posição da cabeceira do doente — quanto mais deitado, maior a probabilidade das secreções passarem para as vias aéreas e as pessoas fazerem pneumonias.
A terceira infeção mais frequente é a infeção associada à cirurgia. E a prevenção da infeção no local cirúrgico tem a ver com o procedimento cirúrgico em si, mas também com o antes e o depois da cirurgia — porque o momento da cirurgia é onde se cumprem todas as condições de rigor, com toda a gente esterilizada, com a pele desinfetada com técnica assética, et cetera, et cetera. Antes da cirurgia, uma das coisas que é feita é a estabilização das doenças crónicas — as diabetes e bronquites crónicas devem ser controladas, as pessoas que fumam devem deixar de fumar. O local da cirurgia [no corpo do doente] tem de ser preparado o menos possível. Antigamente, usavam-se as rapações numa extensão muito grande e essa rapação era feita com lâminas, muitas vezes em casa. Percebemos que cada vez que usamos uma lâmina para cortar pelos, a lâmina vai provocar fissuras. Às vezes provoca lesões e a pele sangra, mas mesmo que não provoque uma hemorragia, provoca pequenas fissuras e as bactérias que estão na pele vão infiltrar-se nessas fissuras e crescer. Há aqui dois aspetos: criar a fissura e o tempo que decorre entre a criação da fissura e a pessoa ser operada. A recomendação hoje é: se for possível não fazer a tricotomia — cortar os pelos —, não se corta; se for para fazer, é feita com máquinas especiais que existem nos hospitais, que não provocam lesão na pele; e a tricotomia deve ser feita imediatamente antes da operação, ou seja, à porta do bloco operatório, para diminuir o tempo entre o corte e o crescimento de bactérias, porque levam logo com o antissético. Por favor, ninguém use lâminas. Por favor, ninguém corte pelos.
A última infeção associada aos cuidados de saúde é a infeção da corrente sanguínea — bacterémias, existência de bactérias no sangue — e que estão, normalmente, associadas aos cateteres venosos. Isso implica boa técnica assética [livre de micróbios] na colocação e boa técnica assética no manuseamento dos acessos vasculares — e aí também temos um grande esforço para fazer. Temos de melhorar nestes aspetos todos.

No âmbito da Semana Mundial de Sensibilização para a Resistência Microbiana, a Organização Mundial de Saúde faz algumas recomendações básicas – OMS
E o que tem sido feito para melhorar estas práticas?
A DGS, há dois anos, lançou as recomendações nacionais de prevenção de cada um destes tipos de infeções, com uma adaptação das recomendações internacionais. Todos os hospitais devem, em teoria, adotar estas normas e devem medir se, para cada das recomendações, está ou não a ser feito. Neste sentido devemos falar não só de bactérias, mas também das taxas de infeções. Portugal tem tido uma redução muito grande nestas infeções [associadas aos cuidados de saúde] todas. Temos feito grandes progressos. Só se dão estes números das resistências aos antibióticos, mas dizer que temos 50% de MRSA, é dizer que da totalidade dos Staphylococcus aureus detetados 50% são MRSA, mas não diz quantos casos são. Já disse no ECDC que precisamos de dizer o número de infeções e a taxa de resistência, senão não traduz a verdade e evolução das coisas.
A percentagem de MRSA tem diminuído em Portugal? O que tem contribuído para isso?
A MRSA é uma bactéria para a qual, apesar de tudo, temos algumas ferramentas para diminuir a colonização. Temos uma solução para dar banho e temos pomadas que se aplicam no nariz e que descolonizam o nariz. A melhoria da MRSA traduz a melhoria global das práticas de controlo de infeção e a melhoria global da utilização de antibióticos (apesar de todas as limitações). E traduz também uma melhoria global em termos de organização.
Os ingleses são um exemplo de como se controla a MRSA. Uma estratégia ao longo de 12 anos em que foram feitas progressivamente sensibilização dos profissionais, melhoria das campanhas de higiene das mãos, melhoria de higiene do ambiente. Uma estratégia em que as administrações hospitalares começaram a ser pressionadas pelo próprio NHS [Serviço Nacional de Saúde britânico], no sentido de serem penalizadas por cada infeção que tivessem, obrigou a uma modificação do comportamento das administrações para a questão das infeções, nomeadamente criaram equipas de controlo de infeção. E, a nível central, o Serviço Nacional de Saúde inglês tem estruturas, devidamente dimensionadas, que produzem normas, que conseguem visitar os sítios, que auditam, emanam relatórios, que permite uma mudança que se vê.
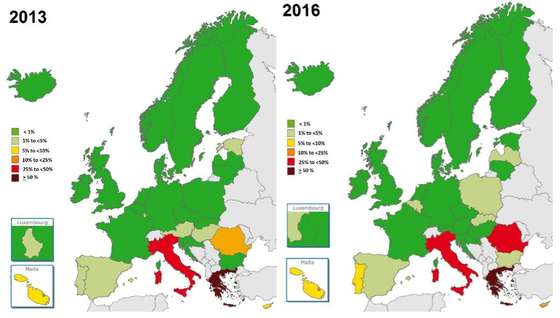
Portugal aumentou a percentagem de Klebsiella pneumoniae resistente aos carbapenemos entre os casos registados no país – EARS-Net/ECDC
A Klebsiella pneumoniae pode ser controlada da mesma forma?
A Klebsiella, ao contrário da MRSA, não vive na pele. A Klebsiella vive nos nossos intestinos. Se tomamos antibióticos e modificamos as Klebsiella ou se contactamos com outro doente que nos passa uma que não é simpática, não conseguimos eliminá-las, porque simplesmente não temos nada para pôr nos intestinos das pessoas neste momento. Existem algumas coisas que se podem fazer, mas muitas delas ainda estão em investigação e não estão em aplicação clínica. Por exemplo, a utilização de concentrados de outras bactérias [bactérias boas], que podemos tomar em comprimidos, podem vir a destruir as Klebsiella, ou a utilização de vírus dirigidos especificamente contra determinadas bactérias [bateriófagos]. Neste momento também são feitos transplantes de fezes — fezes com as bactérias normais — que são colocados como se fossem um clister de limpeza dentro do intestino da pessoa. É feito para o Clostridium difficile para as situações de diarreira recorrente. O Hospital de Gaia é um dos hospitais portugueses que tem essa tecnologia. Envolve alguma logística, com alguma complexidade, mas tem resultados que são inquestionáveis.
Há muito tempo que não se criam antibióticos novos. As bactérias estão a ganhar resistência contras as últimas linhas de atuação e estão a voltar a usar-se antibióticos antigos. É um problema ou não?
Os “velhos” antibióticos deixaram de se usar porque foram surgindo outros que são menos tóxicos ou mais bem tolerados pelos doentes. Como se deixaram de utilizar esses antibióticos, as bactérias não contactam tão frequentemente com eles. Surpreendentemente, esses velhos antibióticos são mais eficazes do que os antibióticos que agora temos em uso. O regresso aos velhos antibióticos é muito desejável. Há uma série de antibióticos que estamos a recomendar vivamente que se voltem a utilizar. E provavelmente daqui a uns anos, aqueles que agora estamos a dizer para não se usar, se calhar vamos recomendar outra vez. Porquê? Porque fizemos uma pausa durante várias décadas e as bactérias recuperaram a sensibilidade para eles.
A questão dos novos antibióticos em desenvolvimento é uma questão complexa, porque custa muito dinheiro e esse investimento não tem um retorno imediato, porque os novos antibióticos ficam como se fossem medicamentos órfãos, ou seja, são para usar apenas em situação de recurso. Há estratégias internacionais que recomendam que o desenvolvimento de novos antibióticos deva ser uma parceria de risco assumida em simultâneo por organismos internacionais, como as agências do medicamento, e as companhias farmacêuticas, e não exclusivamente por estas companhias.
No caso das Klebsiella resistentes aos carbapenemos, neste momento, o problema crescente tem a ver com o controlo de infeção e com a má utilização de antibióticos. E a nível hospitalar existem programas de apoio à prescrição de antibióticos, em que há equipas que estão a verificar que antibióticos estão a ser feitos, a sugerir a modificação dos antibióticos [se for caso disso] e a reduzir a duração das terapêuticas [quando recomendado]. Com isso conseguem-se resultados muito importantes, mas não são imediatos — vão ver-se daqui a dois ou três anos.
Essas equipas existem nos hospitais portugueses?
Essa é uma recomendação do Programa de Prevenção e Controlo de Infeções e de Resistência aos Antimicrobianos, da DGS. Todos os hospitais têm que ter um programa de apoio à prescrição de antibióticos em funcionamento e têm de ter nesse programa a tempo parcial, pelo menos, um médico, uma farmacêutico e um microbiologista. É esta equipa multidisciplinar que vigia e atua sobre a prescrição dos antibióticos, sobretudo dos carbapenemos e das quinolonas, que são os que neste momento nos preocupam mais. Os hospitais, de acordo com a sua capacidade, podem ir mais longe e atuar sobre outras classes de antibióticos — quanto mais melhor. Mais uma vez, estas equipas, tal como as equipas de controlo de infeção, estão subdimensionadas no país inteiro. E há outro problema que tem a ver com os sistemas de informação, isto só pode ser feito se os hospitais tiverem sistemas de informação de gestão em tempo real.
Referiu dois problemas principais: o problema de falta de recursos humanos e o problema logístico. Como é que se resolvem estes problemas?
Resolvem-se com investimento por parte dos hospitais. Os hospitais têm de perceber que todo o investimento nesta área é isso mesmo: um investimento, não um custo. Vão ter um retorno fantástico. Pode não ser na folha de Excel do próprio ano. Mas até pode ser, porque ao reduzirem o consumo inapropriado de antibióticos estão logo a poupar dinheiro. Dinheiro esse que pode ser aplicado para pagar o ordenado das equipas [dos programas de apoio à prescrição de antibióticos], na melhoria das práticas de controlo de infeção e até na utilização de equipamentos, como a vaporização do ambiente com peróxido de hidrogénio, que está demonstrado que reduz a taxa de infeção de um serviço inteiro.
A redução da taxa de infeções com bactérias resistentes também reduz os custos?
Claro. As administrações sabem melhor do que ninguém como é que é pago ao hospital um episódio de um doente — é pago não pelo número de dias que o doente lá está, mas pelo diagnóstico que o doente tem. Portanto, cada dia que o doente fica a mais no hospital, significa que não entra um doente novo e não vem, chamemos, “dinheiro fresco” resultante do doente novo. As administrações hospitalares têm de fazer bem os cálculos: cada infeção custa mais dinheiro, cada infeção impede a entrada de um doente novo porque se prolonga a estadia hospitalar.
Já para não falar daquilo que não é aspeto financeiro, nomeadamente os custos intangíveis para os doentes: o sofrimento, os efeitos secundários, as baixas, tudo o que resulta para o doente, para a família e para a sociedade. E para as próprias instituições é a reputação da instituição. A reputação dos hospitais é uma coisa muito importante. Muitos não medem as taxas de complicações. Os melhores não reportam. Há um problema que é a falta de honestidade em termos globais.
E temos esse problema de falta de honestidade dos hospitais em Portugal?
Não sei. Não sei porque a maior parte dos hospitais não publicita, não reporta publicamente as taxas [de complicações – quedas, infeções, …]. Não é obrigatório. E os relatórios da Administração Central do Sistema de Saúde são criticáveis na sua metodologia [não referem os casos em que os hospitais não medem as complicações].

















