A descoberta de novos antibióticos não acompanha o ritmo a que aparecem bactérias resistentes aos antibióticos mais potentes. Procurar novos tratamentos pode ser uma alternativa ou, pelo menos, um complemento ao uso destes medicamento. Uma destas alternativas é o uso de vírus que infetam bactérias. Uma estratégia aparentemente inovadora, mas que a natureza conhece há muito tempo.
Conhecer melhor estes vírus — chamados de bacteriófagos (que “comem” bactérias) —, e de que forma se relacionam com as bactérias que parasitam é o foco do trabalho de Martha Clokie, investigadora na Universidade de Leicester (Reino Unido). Explicar o potencial que os bacteriófagos têm como alternativas para combater bactérias resistentes a antibióticos foi o tema da palestra que apresentou na 9ª Conferência iMed, em Lisboa.
Os bacteriófagos — e os vírus em geral — não são seres vivos, não são organismos, não têm a maquinaria celular que os seres vivos usam para se alimentarem e se reproduzirem. Os vírus pouco mais são do que um pedaço de material genético dentro de uma cápsula de proteínas, por isso precisam de infetar células que lhes permitam replicar-se. As células que infetam perdem a identidade de origem e passam a agir sob o comando do material genético do vírus.
O vídeo mostra como o bacteriófago T4 infeta a bactéria Escherichia coli.
Uma das principais características dos bacteriófagos é que são específicos para o seu hospedeiro — cada fago só infeta uma estirpe de bactéria. Esta característica é, ao mesmo tempo, uma vantagem e uma desvantagem. É vantajoso porque, ao contrário dos antibióticos, a utilização de bacteriófagos não vai destruir as comunidades de bactérias “boas” que vivem no nosso organismo. A desvantagem é que, enquanto um antibiótico pode servir para combater vários tipos de bactérias, para se usarem bacteriófagos é preciso saber precisamente que estirpe de bactéria causou a infeção.
Mas existem outras vantagens da utilização de bacteriófagos, como a capacidade de penetrar o biofilme — uma matriz que protege a comunidade de bactérias — que os antibióticos não têm ou de chegar a sítios que os antibióticos não chegam, referiu a investigadora. Além disso, o nosso corpo já está habituado à presença de fagos, logo não se espera que haja rejeição ao tratamento. E os fagos são um “medicamento” capaz de se replicar dentro do nosso organismo (usando as bactérias que infeta).
E não podemos ainda esquecer que os fagos são inimigos naturais das bactérias, logo não se espera que estas desenvolvam resistência contra eles, ao contrário do que acontece com os antibióticos. De cada vez que se usa um antibiótico e este não é capaz de matar todas as bactérias patogénicas (que causam doença), as que sobrevivem terão maior capacidade de resistir a um próximo uso desse antibiótico e vão passar essa característica à descendência.
Se os fagos são assim tão incríveis, porque não são mais usados? Porque são difíceis de encontrar, pelo menos o bacteriófago certo para cada aplicação, porque é difícil mantê-los viáveis num frasco de medicamento e porque não é fácil replicá-los em laboratório, explicou Martha Clokie. Mas a investigadora não desistiu e pôs mãos à obra para os encontrar. Neste caso, mãos no lodo.
A maior parte das bactérias que no nosso corpo se comportam como patogénicas, existem livremente na natureza. E onde existem bactérias, existem os bacteriófagos que as parasitam. Logo, o mais fácil é recolher uma boa quantidade de lama e solo para se procurarem os fagos. Bem, se o objetivo for combater a bactéria que provoca a doença de Lyme, o melhor é procurar os bacteriófagos nas carraças que transmitem a doença.
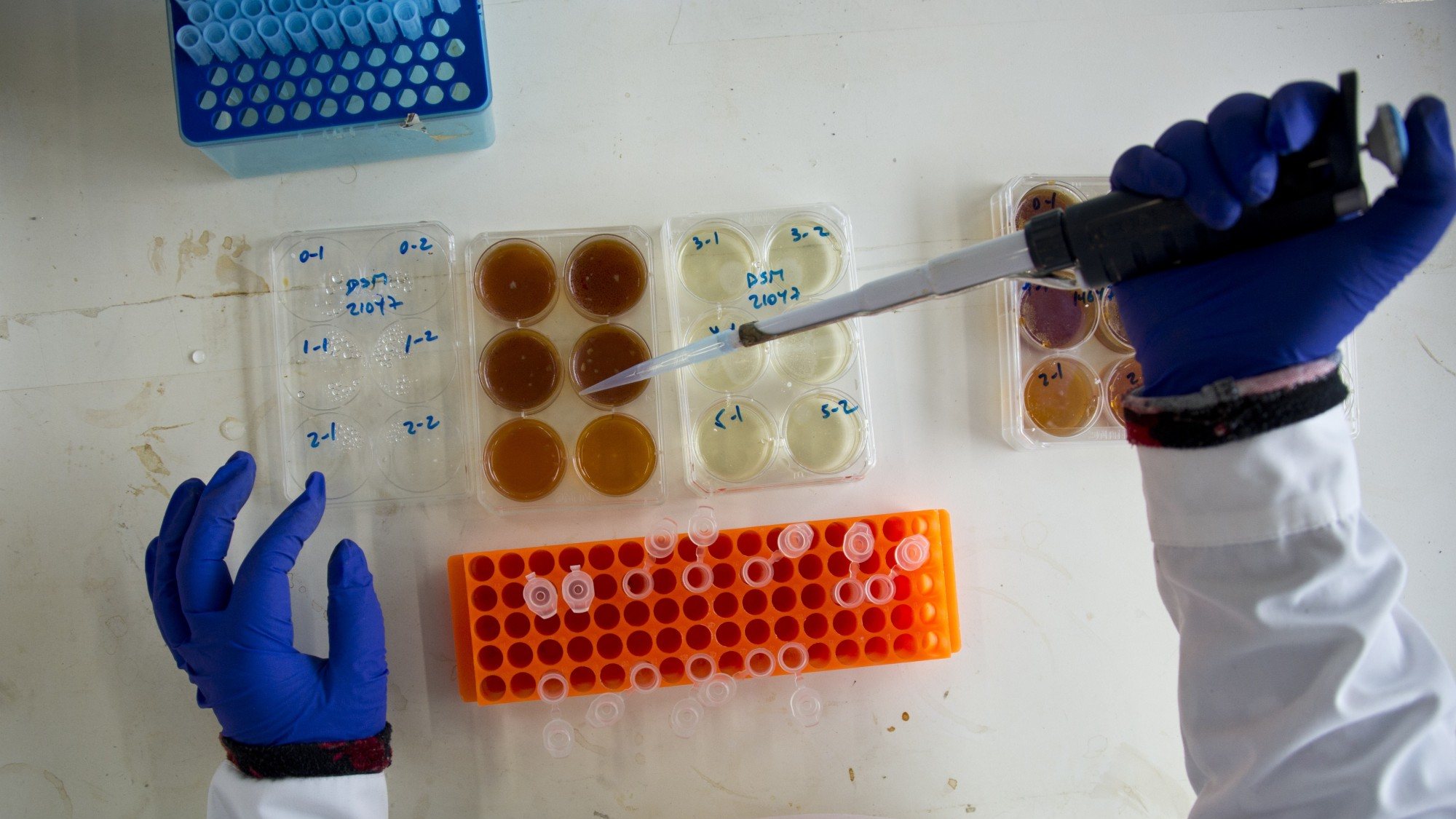
Para se descobrir se uma amostra tem os fagos que se procura ou não, basta juntar a bactéria que se quer combater. Os bacteriófagos parasitam a sua bactéria específica para se conseguirem replicar, portanto a presença da bactéria certa vai fazer com que a quantidade de bacteriógafos aumente. Depois é preciso purificar a amostra e ficar só com os fagos.
Mas este não é o fim do percurso. Uma vez isolados os bacteriófagos recolhidos na natureza, é preciso identificar os que são mais agressivos, aqueles que têm maior capacidade de destruírem as bactérias-alvo. Martha Clokie dá como exemplo o trabalho que tem desenvolvido com Clostridium difficile, uma bactéria que vive no nosso intestino — que quando cresce descontroladamente pode provocar diarreia, entre outros sintomas. Existem cerca de 400 formas diferentes de C. difficile, portanto era importante não só encontrar os fagos que as combatessem, mas aqueles que combatessem o maior número de formas diferentes. Neste momento, a investigadora tem uma lista com sete candidatos.
Como próximos passos, antes de poder levar a utilização destes bateriógafos a ensaios clínicos, Martha Clokie pretende perceber se os bacteriófagos selecionados afetam os outros micróbios do intestino – as bactérias “boas”. Além disso, para fazer chegar os bacteriógafos ao intestino sem que sejam destruídos pelo ácido do estômago é preciso criar uma cápsula que os mantenha intactos até chegarem ao destino.