Já passaram mais de 20 anos desde que Ian Wilmut teve uma “filha” especial — a Dolly. O nome Dolly não foi escolhido por ele, mas não hesitou em aceitá-lo. Era uma homenagem à cantora de música country Dolly Parton. Afinal Dolly, a ovelha, tinha sido clonada a partir da glândula mamária de uma ovelha adulta.
“There’s no such thing as baaaad publicity”, terá dito o agente de Dolly Parton na altura. [“Não existe má publicidade!”, com enfâse no som “baaaad” que lembra o balido de uma ovelha.]
O embriologista britânico começou por trabalhar com a congelação profunda de sémen de javali — uma congelação que permitisse que os espermatozoides se mantivessem viáveis —; passou pela criopreservação de embriões que pudessem ser implantados noutras fêmeas que não a mãe; e chegou ao primeiro organismo clonado a partir do material genético de um adulto.
Em 2005, Ian Wilmut deixou a clonagem, a investigação em animais de quinta e o Instituto Roslin, na Universidade de Edimburgo (Escócia), para dirigir o Centro de Medicina Regenerativa, na mesma universidade, e passar a trabalhar com células estaminais e as doenças que afetam os humanos.
Aos 73 anos considera que teve um percurso profissional afortunado. “Tive muita sorte na minha carreira, com as pessoas que foram meus professores, que eram muito dotados e muito pacientes, e com as pessoas com as quais colaborei.” Agora que se casou pela segunda vez, que já não tem centros para dirigir ou investigação para fazer, acha que vai aproveitar a oportunidade para se reformar.

▲ Ian Wilmut e a ovelha Dolly - Instituto Roslin, Universidade de Edimburgo
Instituto Roslin, Universidade de Edimburgo
É mais conhecido como o “pai” da ovelha Dolly, mas trabalhou com outros animais antes disso. Um deles foi Frostie, o embrião de vaca congelado. Quão importante foi ter uma cria de vaca nascida de um embrião criopreservado?
Assim que o método se mostrou fiável e repetível tornou-se muito usado na reprodução de gado. Quando se levam animais de Portugal para a Escócia, o clima é diferente e os animais levam algum tempo a adaptar-se. Portanto, se pegarmos num embrião congelado e o colocarmos diretamente numa vaca noutro país, a cria já nasce naquele país como uma mãe que toda a vida viveu ali. E isso é vantajoso.
E também é muito mais prático. Os embriões podem ser recolhidos quando é mais cómodo. Tratamos uma série de dadores ao mesmo tempo e não precisamos de nos preocupar se vamos ter quatro óvulos de cada vaca ou dez ou o que seja. Basta-nos recolher os embriões, congelá-los [criopreservá-los] e usá-los quando houver animais disponíveis para os receberem. Em termos práticos, esta técnica foi muito útil na criação de gado.
Ainda antes da Dolly houve outra ovelha famosa, a Tracey. Esta ovelha era capaz de produzir proteínas humanas no seu leite, correto?
Sim, em altas concentrações.
Estas proteínas chegaram a ser usadas?
Não. Para que pudessem ser usadas tinham de ser produzidas por animais com um padrão de saúde particularmente elevado. E não nos podemos dar ao luxo de usar animais com este padrão de saúde em investigação que visa apenas estabelecer a metodologia.
Por essa razão prática, foi criada uma companhia para explorar esta tecnologia. Para atingir o padrão de saúde que precisávamos foram importados animais selecionados da Nova Zelândia — os animais têm um estado de saúde elevado porque estão isolados na ilha. Estabelecemos os padrões da Nova Zelândia no este da Escócia, em quintas com isolamento, e, de facto, criaram-se animais capazes de produzir as proteínas humanas.
Infelizmente, as dificuldades práticas tornaram-se muito relevantes. Apesar de se terem produzido proteínas humanas, nenhuma delas se mostrou clinicamente viável. Portanto, a companhia que estava a desenvolver este trabalho acabou por fechar. Do nosso ponto de vista, a técnica funciona e fomos capazes de produzir muitas proteínas diferentes em concentrações razoáveis. O problema é que as proteínas que estávamos a produzir não eram úteis em termos clínicos.
Depois temos também as ovelhas Megan e Morag. São ovelhas clonadas?
Sim. Eram clones de células de uma fase inicial da gravidez. Experiências com rãs, há 50 anos, mostraram que fazendo a transferência do núcleo numa fase muito precoce do desenvolvimento obtínhamos melhores resultados do que se esperássemos por uma fase mais avançada da gravidez. Mais, os núcleos retirados de células de indivíduos próximo da idade adulta não produziram qualquer descendência.
Megan e Morag foram criadas a partir de células da fase inicial do desenvolvimento. Foi uma pequena demonstração do sucesso da técnica, mas não foi um grande avanço. Mostrou simplesmente que as técnicas que precisávamos para colher embriões, para recolher a informação genética, para fazer crescer as células e para fundir uma dessas células com o óvulo — ao qual já tínhamos retirado o núcleo com a informação genética –, conseguiam produzir um embrião potencialmente viável. Foi, ainda assim um passo importante. E nós fizemos uma festa de qualquer forma. [risos]
Depois disso surgiu a Dolly. Quão diferente é a técnica usada para criar a Dolly, em relação à técnica usada para criar Megan e Morag?
Dolly foi o primeiro animal a ser originado retirando a informação genética do núcleo de uma célula adulta e colocando essa informação num óvulo. Foi a primeira vez que isto foi feito em qualquer espécie. Todas as provas antes disso sugeriam que era muito, muito difícil, até mesmo impossível, impraticável. E isso não era verdade.
Há dois pontos importantes a frisar. Em primeiro lugar, a célula que retirámos da glândula mamária do adulto ainda tinha, obviamente, toda a informação genética. Em segundo lugar, havia fatores no óvulo que usámos que tinham a capacidade de mudar a função dessa informação genética. Tudo o que tinha sido alcançado durante a gravidez [no dador], foi rebobinado para o início da gravidez [no óvulo clonado] e mudado para adquirir a capacidade de crescer durante a gravidez outra vez. Isto mostrou-nos que o sistema era muito mais flexível do que pensávamos. Vimos que provavelmente seria possível usar isto de formas muito diversas. Isto foi muito importante em termos científicos.
Tenho uma dúvida: a Dolly é um clone verdadeiro? Pergunto isto porque o óvulo usado manteve as mitocôndrias e o ADN mitocondrial tem implicações no desenvolvimento.
Tem razão, a Dolly não é exatamente um clone, porque é impossível introduzir as mitocôndrias do dador na célula em que se introduz o núcleo. Mesmo assim mantivemos a designação de clone. Mas tem razão, não é um clone perfeito.
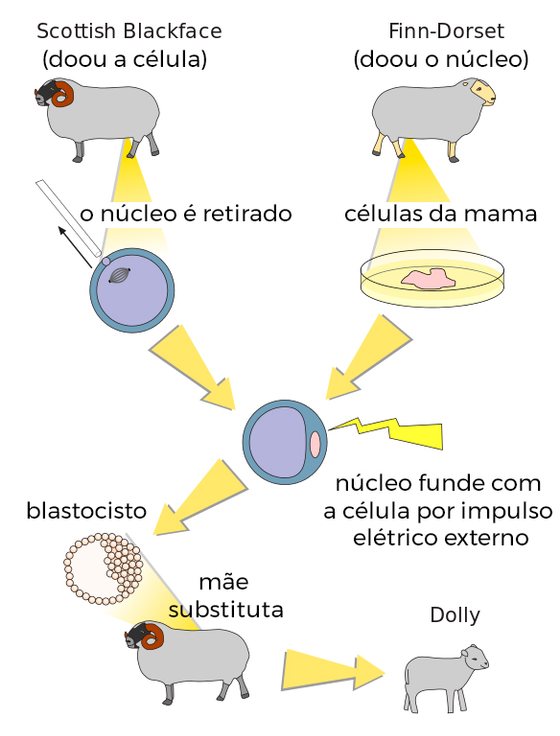
Clonagem da Dolly ou como uma ovelha de face branca nasce de uma ovelha de face negra
E agora uma curiosidade: é verdade que o nome da Dolly foi inspirado na cantora Dolly Parton?
É, com certeza. A ideia não foi minha, foi de um dos meus colegas e eu achei estupenda. Alguém perguntou à Dolly Parton o que achava da ideia e o agente dela respondeu: “There’s no such thing as baaaad publicity!”[risos] Ninguém se importou e muita gente pensou que era divertido.
Os embriões clonados cresciam ao longo de 150 dias nas mães substitutas. Às vezes estas ovelhas tinham dificuldade em dar à luz, por isso tínhamos pessoas a acompanhá-las, nas últimas semanas de gestação, 24 horas por dia e sete dias por semana, para garantir que a mãe e a cria sobreviviam. Pode imaginar o quão aborrecido é ficar sentado num estábulo no inverno, quando está escuro e frio. E houve duas pessoas que fizeram isto muitas vezes. Foi um deles que teve esta ideia, que se espalhou como um fogo selvagem. [risos]
Na altura foi controverso ter uma ovelha clonada? Enfrentou muitas críticas? Como as geriu?
Foi controverso. Não anunciámos que a gravidez estava a decorrer. Achávamos que era mais fácil fazermos primeiro e depois ser totalmente claro sobre o que tínhamos alcançado e sobre quais as vantagens e desvantagens.
Isto cobria uma série de questões biológicas: a transferência de genes, a transferência de um núcleo numa fase precoce, a clonagem. E a minha experiência diz-me que se explicarmos às pessoas porque estamos a fazer determinada coisa, a maior parte das pessoas — não todas, mas a maior parte — vai achar que se pode fazer, desde que sejamos tão cuidadosos quanto possível a tratar os animais.
No caso da Dolly mostrámos, pela primeira vez, que era possível fazer alterações genéticas precisas. As pessoas já o faziam em ratos usando células estaminais há dez anos ou assim. Mas esta foi a primeira vez que o tornámos possível em gado. E isso foi potencialmente uma grande vantagem.
Que vantagem foi essa?
Na altura, o conhecimento permitia provocar alterações genéticas de forma a que os animais tivessem doenças semelhantes às que afetam os humanos. Mas estudar doenças pulmonares em ratos têm-se mostrado muito difícil. Pode imaginar que é muito difícil observar os pulmões de um rato porque são tão pequenos. Por isso têm-se tentado fazer as mesmas modificações em porcos, penso eu, e verificou-se que não só é mais fácil de trabalhar com estes animais como a biologia é mais semelhante à dos humanos. Estes tipos de modificações surgiu da capacidade de fazer alterações genéticas com precisão.
A maior descoberta que conseguimos com a Dolly — e para ser franco não estávamos à espera disso — é que toda a informação genética estava lá e que a função dessa informação genética podia ser mudada pelo óvulo. Quando as pessoas começaram a refletir sobre isto questionaram-se sobre se haveria outras formas de conseguir as mesmas modificações.
Células estaminais pluripotentes
↓ Mostrar
↑ Esconder
As células estaminais pluripotentes têm uma elevada capacidade de divisão e podem diferenciar-se em qualquer célula ou tecido de um adulto.
Estas células existem no embrião – células estaminais embrionárias -, mas também podem ser criadas em laboratório a partir de células diferenciadas adultas que voltam a ter características de células estaminais – células estaminais induzidas.
Duas grandes equipas, uma no Japão e outra no Wisconsin, descobriram que se colocassem determinadas proteínas nas células adultas, como as células da pele, estas tornavam-se muito semelhantes à células estaminais embrionárias. Estas células [estaminais pluripotentes induzidas] mantêm a capacidade de formar todos os diferentes tecidos de um animal ou de uma pessoa. Portanto, é incrivelmente útil para a investigação e talvez um dia sejam usadas para terapia.
Suponhamos que temos uma pessoa com esclerose lateral amiotrófica que nos dê uma amostra de sangue. Podemos fazer o mesmo que as pessoas no Japão e no Wisconsin fizeram: pôr uma seleção de proteínas nas células para que elas voltem a comportar-se como células estaminais e para voltarem ter a capacidade de fazer todos os outros tecidos. Depois compara-se estas células [doentes] com as células saudáveis, tenta perceber-se o que se passa de errado com a doença e procuram-se drogas que protejam as células. Existem centenas, provavelmente milhares, de doenças hereditárias como esta que não se compreendem e para as quais não existe tratamento.
Esta técnica é mais vantajosa do que a clonagem?
A clonagem não funciona bem em humanos. Os primatas, incluindo os humanos, são de alguma forma diferentes e o procedimento que criámos [com a Dolly] não funciona de todo. Há quem tenha feito alguns progressos e que esteja a conseguir fazer células estaminais embrionárias por esse processo. Portanto, tem razão, isso potencialmente é uma alternativa e há grupos que continuam a tentar usar esta técnica.
A técnica japonesa é para fatores de transcrição e basta colocá-los nas células e elas modificam-se para se tornarem células estaminais embrionárias. No início, era uma percentagem muito reduzida — um em 50 mil células que mudava — mas pelo menos conseguia-se a célula certa. Tenho a certeza de que consegue perceber pelo meu discurso que a minha preferência é usar estas novas células estaminais.

▲ Ian Wilmut esteve em Lisboa para a Conferência iMed organizada pelos estudantes de Ciências Médicas da Universidade Nova de Lisboa - Cláudio Noy
Cláudio Noy
Foi por isso que mudou da clonagem para a medicina regenerativa?
Sim. Foi exatamente por isso.
Enfrentou críticas por ter virado as costas à clonagem? Afinal é o pai da ovelha Dolly.
[risos] Um pouco, não muito. Muita gente me perguntou porquê. E eu não me importo de responder porquê.
Porque é uma técnica mais fácil? E com mais potencial?
Para mim, o mais importante é que neste momento iríamos precisar de mulheres jovens que passassem por um processo equivalente ao da fertilização in vitro para doarem alguns dos seus óvulos. É muito raro, mas às vezes as mulheres morrem. E certamente que passam por algum desconforto. Eu prefiro não ter de pedir para alguém passar por este processo. Talvez um dia seja possível criar óvulos em laboratório.
Qual é a sua opinião sobre a edição genética de embriões humanos?
Depende do que se pretenda fazer. Há algumas doenças relacionadas com as proteínas nos glóbulos vermelhos que obrigam o doente a substituir parte do seu sangue com sangue saudável com alguma regularidade durante toda a vida. Acredito que isto seja bastante desagradável.
O que se podia fazer como alternativa era tirar uma amostra de pele ou de sangue do doente, colocar os fatores de transcrição e transformá-las em células estaminais. E, usando técnicas modernas de edição genética, corrigir o erro genético. Depois, analisava-se as células tão exaustivamente quanto possível, porque o que mais preocupa as pessoas hoje em dia é saber se a correção é exatamente aquilo que desejávamos. Se o pedaço de ADN corrigido ficou colocado num local diferente do que devia é mais difícil de procurar, mas temos todo o tempo para o descobrir. Tendo a certeza de que tudo está bem, podemos fazer crescer algumas das células estaminais do sangue e colocá-las na criança e, em princípio, curar a doença de uma vez por todos. Para algo deste género não vejo problemas éticos.
Mas se pensarmos em fazer alterações que se reflitam no corpo da pessoa e que possam ser passados à descendência, isso é muito diferente. É um problema maior em termos éticos: “Que direito temos nós de fazer isso à próxima geração?” Mas também existe um maior risco de erro: podemos não conseguir aquilo que queríamos ou podemos conseguir aquilo que queremos e mais alguma coisa. Fazer mudanças para ter uma criança muito atlética ou muito inteligente é um absurdo de qualquer forma, porque provavelmente não sabemos fazê-lo, mas também porque é um risco que acho eticamente inaceitável.
Bebés de três dadores
↓ Mostrar
↑ Esconder
Em 2015, o Parlamento britânico aprovou o uso de uma técnica de reprodução medicamente assistida que conta com o contributo de três dadores: o pai, a mãe e um terceiro dador feminino.
A maior parte do material genético (99,9%) tem origem no pai (espermatozoide) e na mãe (núcleo do óvulo). O terceiro dador fornece uma célula, um óvulo sem núcleo, que mantém todos os componentes funcionais, incluindo mitocôndrias saudáveis.
Esta técnica destina-se sobretudo a resolver situações em que existem defeitos genéticos no ADN presente nas mitocôndrias da mãe e que poderiam causar doenças graves no bebé.
E em relação aos bebés de três pais, que foi aprovado no Reino Unido, qual a sua opinião sobre esta técnica?
Esta técnica pretende evitar doenças relacionadas com o ADN mitocondrial. Quando os pais têm um erro nos cromossomas é possível tirar uma ou duas células do embrião e ver se ele tem esse erro ou não. E é uma análise bastante fiável. Mas as mitocôndrias podem não ser iguais de uma célula para a outra — não pergunte como ou porquê porque ainda não entendi. Noutros termos, a análise genética que antecede a implantação do embrião não funciona para avaliar o ADN mitocondrial.
Sendo que esta técnica [introdução do núcleo da mãe num óvulo de uma dadora] é usada numa fase inicial do desenvolvimento, e nestas fases iniciais o sucesso é maior, há uma probabilidade grande de funcionar. Não só no sentido de levar a bom termo uma criança, mas também no sentido de evitar uma doença mitocondrial. Estou totalmente a favor disso.
A técnica CRISPR
↓ Mostrar
↑ Esconder
O sistema CRISPR faz parte da resposta de defesa das bactérias contra vírus. Funciona como um mecanismo de memória genética que permite à célula identificar e destruir o invasor.
Este sistema pode ser programado para, nas células de mamíferos em estudo (ratos ou humanos, por exemplo), identificar e editar porções específicas de ADN. A técnica é descrita como um “corta e cose” de elevada precisão.
Com este sistema, é possível modificar permanentemente os genes das células e espera-se que no futuro possa ser usado para corrigir mutações genéticas que causem doenças. A técnica também pode ser usada para estudar a função de cada gene nas células.
Há uma técnica de edição genética de embriões humanos que se tem desenvolvido, a CRISPR [ver caixa]. Que potencial vê nesta técnica?
Neste momento é a forma mais precisa de fazer manipulação genética. De cada vez que falarmos de alterações nos genes, provavelmente vamos usar a técnica CRISPR. Quando falamos da introdução de genes para fazer com que as ovelhas produzam proteínas humanas no leite, o sistema CRISPR pode ser usado para introduzir essas alterações.
Mas também tem riscos associados e questões éticas. Como podem ser ultrapassados?
As pessoas podem achar que sim, mas ainda não podemos dizer que a técnica é absolutamente precisa. Existem ainda alguns erros. Temos de ser muito cuidadosos a fazer testes para ver se conseguimos aquilo que queríamos e não outra coisa qualquer.
Isso vai ser sempre um problema para a manipulação genética, o facto de podemos ter efeitos colaterais?
É uma boa questão. Eu sou um otimista. Agora é certamente o caso, mas as pessoas estão a trabalhar afincadamente para melhorar a técnica e acho que um dia serão bem sucedidas. Teremos um sistema que será 100% preciso. Mas posso estar errado.

Vera Novais/Observador
O que espera do laboratório do qual foi diretor – o Centro de Medicina Regenerativa, na Universidade de Edimburgo – num futuro próximo?
O diretor atual, Stuart Forbes, tem trabalhado no sentido de aumentar a produção de algumas células que são importantes do ponto de vista da resistência à doença. Ele e outras pessoas também conseguiram projetos de reparação do fígado. Na Escócia temos uma incidência terrível de falência do fígado e não existem fígados suficientes disponíveis para cirurgia. Encontrar maneiras de ajudar o fígado a reparar-se a si próprio com células que lá colocamos em vez do transplante de fígado será extremamente útil na Escócia. Estão a fazer alguns ensaios clínicos para estes projetos, o que significa que a aplicação clínica está a uns dez anos de distância.
Voltando ao tempo em que iniciou a universidade, desejava estudar Ciências Agrárias para poder ajudar os países em vias de desenvolvimento. Chegou a fazer algum trabalho neste sentido?
Nunca o fiz em termos de agricultura e também não sou médico, portanto não posso fazer trabalhos em medicina humana. Mas estou certo que alguns dos trabalho que desenvolvemos foram disseminados pelo mundo, incluindo pelos países mais pobres. Há um esquema [Biblioteca de Células Estaminais Pluripotentes Induzidas] a ser desenvolvido para o uso destas células estaminais pluripotentes, para que haja compatibilidade imunológica útil para a maior parte das pessoas do mundo. Estou a fazer campanha nesse sentido. Em poucas dezenas de anos isso vai criar oportunidades em países mais pobres.
Nem todas as pessoas o fazem. Ninguém no centro onde trabalhava está envolvido nisso. Mas eu tento incentivar a ideia sempre que posso.