Se quisermos comparar o fígado, órgão central do nosso metabolismo, a um instrumento musical, na sua melodia concertada no corpo humano, temos uma dificuldade intransponível. O mais correto será considerá-lo antes o regente de uma orquestra multifacetada a quem não se permite qualquer desafino para que tudo funcione na perfeição, nessa constante diligência regenerativa para evitar que as células morram de vez.
O fígado é responsável pela seguinte orquestração: produção de bílis, necessária à digestão de alimentos, garante do armazenamento de glucose, na forma de glicogénio (e, depois, na conversão em glucose quando o organismo necessita de energia). Além disso, produz fatores de coagulação e proteínas, é responsável pelo metabolismo do ferro, pela produção de colesterol, pela eliminação dos produtos resultantes do metabolismo através da bílis e pela metabolização de medicamentos. Sem ele, a sinfonia da vida acaba.
Como é que as células morrem? Quais são os mecanismos fundamentais através dos quais chegam à morte celular e como é que esta se pode evitar, quando ela é responsável pela doença?”
Estas eram algumas perguntas que inquietavam Cecília Rodrigues, investigadora da Faculdade de Farmácia da Universidade de Lisboa (FFULisboa), que entrou no mundo da morte das células do fígado porque queria compreender os mecanismos biológicos que levam a esse ponto sem retorno. Para a cientista, as questões têm estado desde sempre “relacionadas com as raízes da Biologia, mas ligadas à saúde”, porque, “já tinha o ser humano no centro das preocupações: a doença e o tratamento como prioridades”.
O atual projeto que coordena no laboratório Cellular Funcion and Therapeutic Targeting Group, integrado no Instituto de Investigação do Medicamento, “LiveRIP – RIPK3 Biology and Targeting in Metabolic Liver Disease”, é a investigação que melhor sintetiza os seus objetivos científicos: transformar ciência fundamental em intervenção médica.
E, neste caso, à procura de novos alvos terapêuticos para diagnosticar e controlar o fígado gordo, ou “doença metabólica do fígado”, nome que a investigadora natural de Penedono (Viseu) considera mais adequado. “Fígado gordo não alcoólico tem um certo estigma associado e ‘doença metabólica do fígado’ tem vindo a ganhar mais adeptos. Existe até uma proposta para alterar essa designação”, realça a cientista. A ideia é “chamar a atenção para os fatores de risco que são fatores metabólicos, independentemente do consumo de álcool”.
O projeto que Ceília Rodrigues coordena foi financiado pela Fundação “la Caixa” em 320 mil euros e conta, atualmente, com uma equipa principal de dez pessoas — “às quais se juntam colaboradores nacionais e internacionais” —, propondo-se analisar, de forma aprofundada, as perturbações metabólicas que resultam da morte inflamatória de células hepáticas na esteatohepatite não-alcoólica (NASH), que podem atuar como alvos terapêuticos e biomarcadores de atividade na doença hepática gorda não-alcoólica (NAFLD).
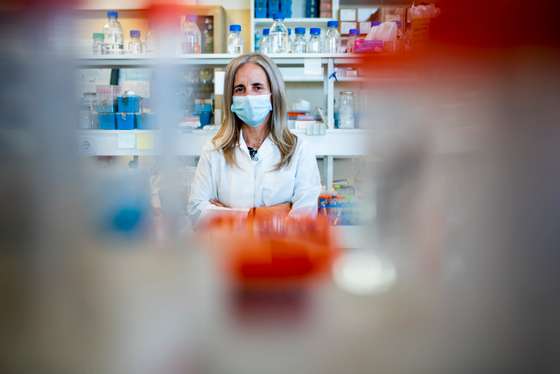
A cientista pretende analisar as perturbações metabólicas que resultam da morte inflamatória de células hepáticas na esteatohepatite não-alcoólica, que podem atuar como alvos terapêuticos e biomarcadores de atividade na doença hepática gorda não-alcoólica
Até 2024, a equipa tem alguns objetivos. O primeiro é “prever a progressão da NAFLD com base em conjuntos de dados não clínicos e clínicos”, através de experiências com ratinhos, comparando esses resultados com dados de doentes com doença metabólica do fígado, em parceria com o Hospital de Santa Maria. Depois, “investigar aspetos multifuncionais da atividade RIPK3 na NAFLD” — ou seja das proteínas RIPK: Receptor-interacting protein kinase [“proteínas cinase, que intervêm em reações metabólicas de fosforilação”].
Trata-se de uma proteína que Cecília Rodrigues e a equipa consideram que poderá ser fulcral para encontrar um alvo terapêutico eficaz para a doença metabólica do fígado. “A RIPK3 parece ter um papel importante, não só na morte das células mas também no seu metabolismo. A nossa ideia é que as células morrem porque o metabolismo está alterado, até ao ponto de não retorno, em que não conseguem recuperar.” A proteína parece controlar não só os aspetos metabólicos do funcionamento da célula, mas também a sua desregulação até um determinado ponto.
Nesse sentido, ressalva a coordenadora do liveRIP, a equipa está igualmente empenhada em encontrar “melhores modelos experimentais para as doenças de fígado gordo. É que, em muitos casos, os atuais modelos experimentais não as refletem na totalidade e, portanto, temos sempre esta ambição de chegar ao modelo ideal, que reflita a patogénese da doença“.
Finalmente, o outro objetivo é “qualificar novos inibidores independentes e dependentes da RIPK3 que alteram o curso da NAFLD”, explica. “Este impacto científico é fundamental, pois ao compreender melhor esta atividade multifuncional da proteína e da sua relevância na doença metabólica do fígado, daí iremos retirar informação para identificar alvos terapêuticos, para o desenvolvimento de novas moléculas e de novas estratégias terapêuticas.”
É reconhecido que a doença do fígado gordo não alcoólico é a patologia crónica do fígado mais frequente, afetando um terço da população mundial (na Europa, a prevalência é de cerca de 25%). Depois, o aumento da diabetes e da obesidade, duas doenças do foro metabólico a nível mundial, aumenta o risco de a desenvolver.

Cecília Rodrigues considera que a proteína RIPK3 poderá ser fulcral para encontrar um alvo terapêutico eficaz para a doença metabólica do fígado. “Parece ter um papel chave importante, não só na mortes das células mas também no seu metabolismo”
De acordo com dados da Global Burden of Disease, a obesidade é um dos principais fatores de risco de morte prematura. E a diabetes é um problema global de saúde pública. Ou seja, estas duas patologias são cada vez mais prevalentes, com números preocupantes a nível global, agudizando o problema de se desenvolver a doença metabólica do fígado. Depois, para agravar o cenário, as alterações metabólicas podem provocar doenças cardiovasculares.
O maior problema, nota a cientista — membro do conselho editorial de revistas científicas especializadas como a Hepatology — é que esta doença “não tem um diagnóstico fiável, nem tratamento”. Com efeito, “um dos alvos terapêuticos por explorar é a proteína RIPK, que incide na morte celular e da qual se desconhece o papel desempenhado no metabolismo e inflamação do fígado”, lê-se na descrição do projeto apresentado à fundação “la Caixa”.
As bases para esta investigação começaram já em 1992, quando Cecília Rodrigues iniciou o Doutoramento da University of Cincinnati, nos Estados Unidos, em parceria com a Universidade de Lisboa. “Durante esse período estudei um medicamento cujos mecanismos não eram conhecidos — e era utilizado na medicina ocidental — para o tratamento de doenças hepáticas. E apercebi-me que o mecanismo da ação desse fármaco era tão geral que, provavelmente, era aplicável a outras doenças.”
Ou seja, a investigadora constatou que esse medicamento poderia ser aplicado para tratar outras doenças onde a morte das células tivesse um papel relevante. “Saí do fígado e fui para o cérebro, para as doenças neurodegenerativas no meu pós-doutoramento na University of Minnesota e isso resultou no registo de quatro patentes globais, da Coreia do Sul ao Japão, aos Estados Unidos e à Europa.” A partir daqui foram criadas duas spin-off, para comercializar a tecnologia, e alargou-se o âmbito de atuação desse medicamento.
Hoje já existem ensaios clínicos na fase final da eficácia desse medicamento para o tratamento de doenças neurodegenerativas. “Eu diria que esta conquista dá sentido ao meu papel na ciência, uma vez que resultou em algo muito concreto que, um dia, pode significar uma diferença para a vida de doentes com doenças neurodegenerativas”, reflete.

As bases para esta investigação começaram já em 1992, quando a investigadora iniciou o Doutoramento da University of Cincinnati, nos Estados Unidos, em parceria com a Universidade de Lisboa
Com esta experiência acumulada, a cientista dá o salto para o projeto “la Caixa” e outras investigações transversais, quer em rede, quer como coordenadora no seu laboratório e que são coadjuvantes para o progresso do liveRIP, até porque as doenças do fígado sempre fizeram parte dos seus interesses centrais, numa ligação com a indústria farmacêutica, por serem doenças muito incidentes.
Cecília e a equipa estão agora à procura das moléculas perfeitas para desenvolver fármacos. Começaram por usar ácido biliar como princípio ativo, “que é uma molécula sintetizada no fígado a partir do colesterol e são essenciais, por exemplo, para absorção de gorduras”. Estudos mais recentes indicam que têm outros papéis muito específicos, “quase como de hormonas”, pois os ácidos biliares em pequenas quantidades “são capazes de regular a função celular e da bioquímica da célula, de forma maléfica quer matando as células, até outros de uma forma benéfica, impedindo a morte das células”. Foi nisso que ela se concentrou e num em especial: o ácido ursodesoxicólico que é uma molécula natural.
”O nome vem da existência de quantidades muito elevadas numa família de ursos em particular – e esse é o princípio ativo do medicamento, que existe nas farmácias para tratar as doenças hepáticas, e que nós estamos a tentar levar também para o tratamento de outro tipo de patologias, pelas propriedades anti-morte celular.”
No fundo, o medicamento aumenta os níveis dessa molécula endógena, que já existe naturalmente no nosso fígado, ou seja, no nosso organismo em circulação, e isso é benéfico, porque protege as células, impedindo as alterações metabólicas do fígado. “Os ursos têm uma enorme vantagem, porque têm-na numa percentagem muito elevada, em 30% a 40% do total de ácidos biliares, em relação a nós, com 3%, daí que é possível que a hibernação dos ursos decorra sem lesões cerebrais pela elevada quantidade que este ácido biliar tem no organismo dos animais que hibernam”.

O projeto que Cecília Rodrigues coordena foi financiado pela Fundação “la Caixa” em 320 mil euros e conta com uma equipa principal de dez pessoas, “às quais se juntam colaboradores nacionais e internacionais”
A cientista acredita que o aspeto translacional da investigação, baseada no conhecimento da biologia dos processos sobre a doença metabólica do fígado, não só permitirá chegar a um medicamento eficaz, como também tem uma “relevância social importantíssima”.
“Estamos a estudar uma doença que afeta 25% da população e não se prevê que venha a diminuir, portanto é muito importante que encontremos uma estratégia terapêutica, com biomarcadores que nos permitam identificar que tipo de doentes podem progredir para formas mais graves da doença e, assim, impedir essa progressão.”
E, uma vez alcançados os resultados com sucesso, garante Cecília, pretendem tornar acessíveis os dados à comunidade científica, de maneira a que possam utilizar estes instrumentos para manter a sinfonia metabólica do fígado funcionalmente bem orquestrada.
Este artigo faz parte de uma série sobre investigação científica de ponta e é uma parceria entre o Observador, a Fundação “la Caixa” e o BPI. O projeto LiveRIP – RIPK3 Biology and Targeting in Metabolic Liver Disease, liderado por Cecília Rodrigues, do ICBAS, foi um dos 30 selecionados (12 em Portugal) – entre 644 candidaturas – para financiamento pela fundação sediada em Barcelona, ao abrigo da edição de 2021 do Concurso HealthResearch. A investigadora recebeu um milhão de euros para desenvolver o projeto ao longo de três anos. O concurso chama-se agora CaixaResearch de Investigação em Saúde e as candidaturas para a edição de 2022 encerraram a 25 de novembro. Os prazos para a edição de 2023 deverão ser conhecidos no verão.