A causa da morte do faraó egípcio Tutankhamon, cerca de 1323 a. C, aos 19 anos, sempre esteve envolta em mistério. Muitas teorias têm surgido ao longo do tempo. Uma delas, de 2010, publicada no Journal of the American Medical Association, defende que o rapaz-faraó, além de uma necrose óssea, estava infetado com o parasita Plasmodium, agente causador da malária, que se transmite pela picada dos mosquitos fêmea do género Anopheles.
A doença é uma das mais antigas pragas da humanidade e, no entanto, ainda hoje, continua a matar uma criança a cada dois minutos. Estima-se que em 2020 a malária tenha sido responsável por mais de 600 mil mortes, a maioria no continente africano. Desde 6 de Outubro de 2021 há uma vacina recomendada pela Organização Mundial de Saúde (OMS), a RTS,S/AS01 ou Mosquirix. O momento foi histórico – trata-se da primeira vacina aprovada contra um organismo infecioso para humanos que não um vírus ou bactéria – mas a sua eficácia está muito longe do desejado, sobretudo em crianças.
A dificuldade em desenvolver vacinas eficazes para uma doença com mais de três mil anos é explicada sobretudo pelas características do próprio parasita que tem cerca de cinco mil genes – por comparação, o vírus SARS-CoV-2 tem apenas 12.
Os parasitas são organismos infinitamente mais complexos do que os vírus ou as bactérias”, explica Miguel Prudêncio, líder de laboratório no instituto de Medicina Molecular João Lobo Antunes, em Lisboa, onde estuda a doença há mais de 15 anos e tenta desenvolver uma vacina há dez.
A complexidade do Plasmodium faz com que seja mais difícil ensinar ao corpo como lutar contra ele. “Uma vacina é uma maneira de ensinar o sistema imunitário a identificar e saber combater um organismo infeccioso. Uma maneira de dizer ao corpo: se voltares a encontrar isto, é para atacar”, ilustra o cientista. Trata-se de proporcionar ao corpo um primeiro encontro que lhe permita criar uma memória imunitária.

▲ A malária é causada pelo parasita Plasmodium, transmitido pela picada dos mosquitos fêmea do género Anopheles. Há cinco espécies de Plasmodium que infetam humanos
Goncalo Villaverde
Acontece que os encontros entre o nosso corpo e os microorganismos são como os encontros entre pessoas: não são todos iguais. Uns ficam guardados na memória até ao fim dos nossos dias, outros esquecem-se rapidamente. “A memória imunitária do sarampo, por exemplo, dura para sempre, por isso, nunca mais voltamos a ter essa doença. No caso do parasita da malária isso não acontece: quando as pessoas contraem esta doença têm uma resposta imunitária e ficam protegidas por algum tempo, mas não para sempre.” A vacina tem, pois, de ultrapassar esta dificuldade e fazer aquilo que o contato natural com o parasita não é capaz de fazer. Por outro lado, o ciclo de vida do parasita inclui várias etapas que ocorrem quer no mosquito – vetor da doença –, quer no hospedeiro mamífero.
Além destas questões, inerentes ao parasita, há os problemas relativos ao financiamento. A malária faz parte de um lote a que convencionou chamar-se doenças negligenciadas ou esquecidas. Após a eliminação da doença na Europa e na América do Norte, nos anos 50 e 60 do século passado, o investimento diminuiu.
A Covid veio mostrar que com muitos recursos e o empenho de todos, é possível ultrapassar dificuldades que, de outra forma, não seriam ultrapassadas. Por isso é óbvio que, com maior disponibilidade de recursos, as dificuldades inerentes ao parasita seriam ultrapassadas de forma mais rápida.”
Desde 2000, o empenho da Fundação Bill e Melinda Gates no apoio à investigação em doenças tropicais tem ajudado a fazer essa diferença. Foi com o financiamento da instituição e da Malaria Vaccine Initiative que o investigador conseguiu, entre 2010 e 2018, desenvolver grande parte do seu trabalho – uma abordagem inovadora à vacinação contra a malária, que chegou a ensaios clínicos em humanos em 2017 e que está agora a ganhar novo fôlego com o financiamento ao abrigo do programa Caixa Research de Investigação em Saúde, que recebeu em 2021.
Uma ideia fora da caixa
Quando entra no corpo, através da picada do mosquito, o Plasmodium infecta o fígado, onde se multiplica. Esta fase é assintomática. Só depois, quando é libertado na corrente sanguínea, causa doença. “A investigação mostra que as vacinas mais eficazes são aquelas que tentam bloquear esta replicação no fígado. Assim, o parasita não vai para o sangue e não há sintomas”, explica o cientista.
As potenciais vacinas que se têm revelado mais eficazes são aquelas que usam o parasita inteiro, numa forma atenuada – por exemplo através de radiação – como agente de imunização. “É a abordagem mais promissora que existe mas, com todas as suas virtudes, tem algumas limitações”. Entre elas estão a necessidade de infectar uma grande quantidade de mosquitos com o parasita da malária humana, ainda não atenuado, o que levanta dificuldade a nível da contenção e segurança. “A outra é que apenas permite vacinas contra o parasita de mesma espécie que é usado na vacina, neste caso o Plasmodium falciparum, não sendo eficaz para a espécie Plasmodium vivax.”

▲ Miguel Prudêncio conseguiu obter um financiamento de um milhão de euros da Fundação “la Caixa” para prosseguir a investigação numa vacina contra a malária
Gonçalo Ribeiro
A trama adensa-se: há cinco espécies de Plasmodium que podem infetar humanos. Três delas são pouco relevantes do ponto de vista de números de casos e de mortalidade, outras duas, o Plasmodium falciparum (endémica em África) e o Plasmodium vivax (a mais comum no sudeste asiático), causam, em conjunto, quase a totalidade dos casos fatais. É mais uma dificuldade: dois parasitas diferentes, e não apenas um, com que lutar.
Mas há, além disso, parasitas de espécies diferentes, que infectam animais. Como o Plasmodium berghei, que infecta roedores, e que é usado em laboratórios de todo o mundo para estudar a doença em ratinhos. É inócua para os humanos – o que salvaguarda questões de segurança – e tem um ciclo de vida idêntico ao das espécies que infetam pessoas – o que permite o estudo rigoroso dos mecanismos da doença. Ora, a grande ideia de Miguel Prudêncio foi esta: usar o parasita Plasmodium berghei, e não os parasitas humanos, no desenvolvimento de vacinas.
Foi em 2008, sentado no gabinete de Maria Mota, diretora executiva do IMM e investigadora na área da malária também, que a ideia surgiu. E surgiu, como quase todas as boas ideias, com um “E se?” Com frequência, os investigadores são picados pelos mosquitos infectados com Plasmodium berghei que usam para as suas experiências, o que não representa perigo porque o parasita não causa doença em humanos, mas apenas nos roedores. “Ficamos só com uma borbulha no sítio da picada. Mas lembro-me que, a certa altura, quase meio a brincar, dissemos: ‘- Se calhar quando somos picados por um mosquito infetado com o Plasmodium berghei, isso não só não nos faz mal, como se calhar até faz bem’”, recorda o investigador.

▲ A malária é uma das mais antigas pragas da humanidade. Mas continua a matar uma criança a cada dois minutos. Em 2020 terá sido responsável por mais de 600 mil mortes, a maioria em África
Jéremie Decalf
A abordagem tem tanto de inovador como de antigo. É que a primeira vacina da história, a da varíola, seguiu precisamente uma abordagem semelhante. No final do século XVIII, Edward Jenner, o seu criador, percebeu que as mulheres que faziam a ordenha das vacas resistiam melhor ao vírus da varíola humana porque já tinham tido contacto com a varíola bovina. “O que Jenner percebeu foi que as respostas imunitárias montadas contra o vírus da varíola bovina protegiam contra o vírus da varíola humana. Nasceu assim a primeira vacina e o conceito de proteção cruzada entre espécies.” E nasceu, aliás, a própria palavra ,que tanto temos usado: “vacina” deriva de “vaccinia“ o nome do vírus da varíola bovina.
Na criação da sua própria vacina, Miguel Prudêncio faz o mesmo: usa o parasita dos roedores para inocular os humanos. Mas não se fica por aqui. Hoje, através da manipulação genética, é possível fazer modificações que mantêm a segurança, mas aumentam a eficácia: assim, introduziram no genoma do parasita dos roedores a proteína que cobre o parasita Plasmodium falciparum – a PfCSP –, que é aquela que gera as respostas imunitárias mais importantes. “É como vestir um casaco ao parasita dos roedores que o disfarça de parasita humano. Quando o nosso sistema imunitário o encontra, além de criar defesas contra o parasita de roedores – promovendo as respostas cruzadas – também monta uma resposta imunitária contra esse ‘casaco’, que vai ser útil no combate ao parasita humano.”
Pôr a vacina num frasquinho
Depois de anos de trabalho, em 2017 a PbVac, a vacina desenvolvida pela equipa de Miguel Prudêncio no iMM e por um conjunto de colaboradores internacionais – com o parasita de roedores “mascarado” de parasita humano –, chegou a ensaios clínicos. Foi, em si, uma proeza, já que foi a primeira vez que um parasita de roedores geneticamente modificado foi administrado a humanos. Os resultados foram agridoces: houve uma diminuição de 95% da infecção hepática. “É bom, mas não chega. Os 95% de diminuição da infecção hepática não correspondem a 95% de proteção: basta que um único parasita passe do fígado para o sangue para se multiplicar nos glóbulos vermelhos e causar doença.” Ou seja: uma vacina só protege da doença de bloquear a infecção hepática a 100%.
Há um pormenor arrepiante que explica muita coisa, dos resultados neste ensaio clínico aos objetivos do atual projeto: a forma como são habitualmente administradas estas vacinas da malária nas primeiras etapas dos ensaios clínicos. As pessoas são inoculadas com picadas de mosquitos. “É a forma como sempre se fez porque a vacina é fabricada pelo mosquito e o parasita está nas suas glândulas salivares. Então, o mosquito é a seringa. Pica as pessoas e injecta a vacina.”
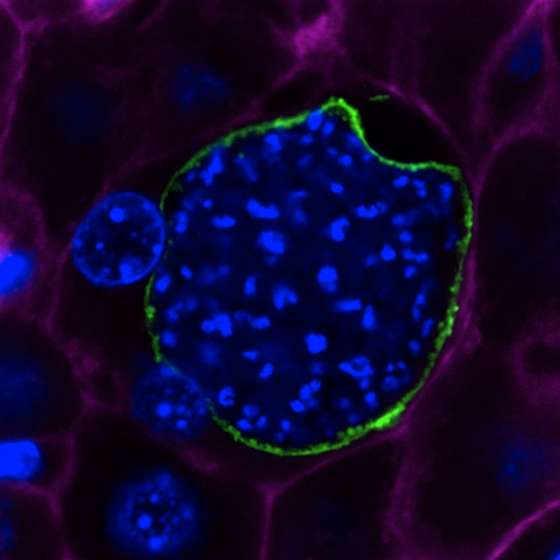
Hepatócito infetado com parasita da malária, Quando entra no corpo, pela picada do mosquito, infeta o fígado, onde se multiplica. Quando é libertado na corrente sanguínea, provoca a doença / © ANTÓNIO MENDES
No ensaio clínico da PbVac foram feitas a cada voluntário quatro administrações de 75 picadas de mosquitos cada. Muito longe, mesmo assim, das três mil picadas que foram, nos anos 1980, autorizadas para testar outras vacinas. Mas isto, claro, cria um problema: a quantidade que se consegue injectar. “Sabíamos desde o início que isso significava fazer o ensaio com uma dose sub-óptima. Ter havido, ainda assim, uma redução de 95% da carga hepática com uma dose tão baixa foi muito bom.”
Com o financiamento de um milhão de euros do concurso Caixa Research de Investigação em Saúde, o cientista vai “tentar resolver os cinco por cento que faltam”. Fá-lo-á de três formas: através de um melhoramento das alterações genéticas do parasita, para o tornar capaz de uma resposta imunitária ainda maior; trabalhando numa versão do parasita de roedores “mascarada” de Plasmodium vivax, para o qual ainda não existe nenhuma vacina e, finalmente, encontrando uma forma de “colocar estes parasitas num frasquinho” e administrar assim a vacina de uma forma mais convencional, e na dose desejada.
Não podemos ir para África vacinar pessoas com mosquitos em gaiolas, nem queremos fazer outro ensaio clínico usando as picadas. Por isso, vamos criopreservar estes parasitas modificados.”
Para isso, vão recorrer à experiência de uma empresa americana, a Sanaria, que desenvolveu uma forma de isolar os parasitas das glândulas salivares do mosquito, purificá-los e congelá-los sem os matar. “Isso permite que se possam administrar por injecção e aumentar a dose.” Sem mais picadas de mosquitos.
Das metaloproteínas à vacina da malária
Miguel Prudêncio, 51 anos, licenciou-se em Bioquímica na Faculdade de Ciências da Universidade de Lisboa e seguiu para doutoramento na área de metaloproteínas – proteínas que contém um ou mais iões metálicos na sua estrutura. Quando terminou o doutoramento, na Universidade de East Anglia, no Reino Unido, em 2000, já sentia que não era propriamente apaixonado por metaloproteínas. Mas insistiu: completou um pós-doutoramento na mesma área na Universidade de Leiden, nos Países Baixos.
Depois chegou o ano de 2005 e, com ele, uma decisão importante: regressar a Lisboa com um contrato de cinco anos, de novo na área das metaloproteínas, ou arriscar uma posição de apenas um ano, a trabalhar em malária com a investigadora Maria Mota. Arriscou. A verdade é que, apesar da estabilidade do contrato de cinco anos, estava farto de metaloproteínas. “Pensei: ou mudo agora ou vou passar a vida inteira a fazer uma coisa que, embora não faça mal, não gosto assim tanto de fazer. Dei-me a oportunidade de largar algo que não me enchia as medidas.”

▲ Nas primeiras etapas dos ensaios clínicos, a inoculação faz-se através de picadas de mosquitos. “A vacina é fabricada pelo mosquito. Pica as pessoas e injeta a vacina”
Diogo Madruga
Está no iMM desde 2005. Inicialmente no grupo de investigação de Maria Mota – onde concluiu o segundo pós-doutoramento, desta vez em malária – e passou mais tarde a staff scientist. Desde 2013 tem o seu próprio laboratório de investigação, atualmente com 12 pessoas, onde estuda a infecção por Plasmodium e intervenções anti-maláricas.
O mais central no trabalho de gestão, garante, é ajudar as pessoas a sentirem-se motivadas, para que façam porque esse é o seu objectivo e não por que são mandadas. Mesmo quando é necessário ser exigente, tem a preocupação de ser diplomático. Adoçar o discurso. “Ainda ontem, a escrever um e-mail, apaguei um ‘isto tem de estar pronto para a semana’ e substitui por ‘gostaria que isto estivesse pronto para semana.’” É que ser líder de grupo implica ser flexível e gerir personalidades muito diferentes. O tamanho único não serve a ninguém. “Há pessoas introvertidas e extrovertidas, algumas são mais assertivas e outras menos, há os que aceitam bem a crítica e os que têm mais dificuldade.”
Adora o que faz, mas não é viciado em trabalho. Gosta – e dedica muito tempo – a estar com a família, a passear, ver séries, ler, experimentar um restaurantes ou fazer uma escapadela de fim-de-semana num turismo rural que ainda não conhece. Tem uma capacidade invulgar que lhe facilita esta gestão: se está ao computador a escrever um artigo e pára para ir fazer outra coisa, quando volta, passada uma hora ou duas, termina a frase que deixou a meio como se não tivesse interrompido o trabalho.

▲ Em 2017 a PbVac, a vacina desenvolvida pela equipa de Miguel Prudêncio no iMM e por um conjunto de colaboradores internacionais chegou a ensaios clínicos
Goncalo Villaverde
Gosta também de escrever e de divulgar ciência. Nesta fase, de pandemia, esteve particularmente ativo e multiplicou-se em colaborações com órgãos de comunicação social, sobretudo para esclarecimento de aspectos relacionados com vacinas. “Sinto como muito importante poder contribuir para disseminar conhecimento, para esclarecer as pessoas. Se houver uma pessoa que não se ia vacinar e se vacinou por me ouvir, já dou por muito bem empregue o meu tempo.”
A malária apaixona-o e as vacinas também. Não coloca em dúvida que haverá vacinas muitos eficazes contra a malária, provavelmente ainda no seu tempo de vida. “E tenho esperança, claro, que a nossa seja uma dela. Acredito mesmo que pode ser.”
Este artigo faz parte de uma série sobre investigação científica de ponta e é uma parceria entre o Observador, a Fundação “la Caixa” e o BPI. O projeto Whole-organism Vaccines against P. falciparum and P. vivax Malaria with eEnhanced Efficacy and Scope, liderado por Miguel Prudêncio, do IMM, foi um dos 30 selecionados (12 em Portugal) – entre 644 candidaturas – para financiamento pela fundação sediada em Barcelona, ao abrigo da edição de 2021 do Concurso Health Research. O investigador recebeu um milhão de euros para desenvolver o projeto ao longo de três anos. O concurso chama-se agora CaixaResearch de Investigação em Saúde e as candidaturas para a edição de 2022 encerraram a 25 de novembro. Os prazos para a edição de 2023 deverão ser conhecidos no verão.

















