Um novo tratamento para o Alzheimer era aguardado há quase 20 anos. Mas a luz verde dada pela autoridade norte-americana do medicamento (FDA, Food and Drug Administration) ao aducanumab, da farmacêutica Biogen, não recolheu o aplauso mundial esperado. Sobretudo porque a agência contrariou o aconselhamento dado pela equipa de especialistas que consultou nesta área.
“Esta foi, provavelmente, a pior decisão em relação à aprovação de um medicamento na história dos Estados Unidos”, disse Aaron Kesselheim, professor de Medicina na Escola Médica de Harvard (Estados Unidos) e o terceiro elemento a sair do Comité Consultivo do Sistema Nervoso Periférico e Central da FDA por discordar com a decisão da agência.
Os especialistas em doenças geriátricas e demência estavam apreensivos em relação aos dados pouco seguros apresentados pela empresa, mas as associações de doentes e familiares mantiveram a pressão sobre a FDA que se mostrava animada com os resultados do medicamento. A farmacêutica, naturalmente, não poderia estar mais satisfeita com o desfecho, especialmente porque estava à beira da falência e com esta decisão poderá vir a faturar milhares de milhões de dólares. A venda do medicamento pode render sete mil milhões de dólares, até 2025, mesmo que apenas 8% dos americanos com doença ligeira façam o tratamento, destacou o New York Times.
FDA abriu a porta a estudos de baixa qualidade para aprovar medicamentos
Quando, em novembro de 2020, a FDA reuniu um grupo de 11 especialistas para rever os dados dos ensaios clínicos apresentados pela Biogen talvez não esperasse ver o produto rejeitado: nenhum dos especialistas considerou haver provas inequívocas de eficácia do medicamento no abrandamento do declínio cognitivo, reportou a Undark. A rejeição, no entanto, não deveria ser uma surpresa já que os ensaios clínicos tinham sido interrompidos em 2019 porque o medicamento se mostrou “inútil”, ou seja, não estava a mostrar qualquer benefício.
O parecer negativo do comité reunido pela própria agência não impediu, no entanto, que o medicamento fosse autorizado num programa de aprovação acelerado especial (normalmente usado em medicamentos contra o cancro). Esta opção pouco comum de ignorar o parecer negativo de um comité independente levou à renúncia de, pelo menos, três elementos, que acusam a agência de não se ter baseado na ciência para tomar a decisão.
“Não é a primeira vez que estou num comité que vota de uma maneira e a FDA decide de outra. [Mas] é a primeira vez que ninguém votou pela aprovação do fármaco — ninguém — e [a FDA] foi contra isso”, disse Scott Emerson, bioestatístico e professor emérito da Universidade de Washington, citado pelo STAT News. Certo é que a FDA não tem de seguir o aconselhamento do painel e foi contra a recomendação em 21% das situações entre 2008 e 2015, mas, nestes casos, a distância entre o sim e o não era pequena, diz o jornal — na presente situação não havia dúvidas sobre a não recomendação.
Numa outra análise à situação, o STAT News destaca que com esta aprovação condicional a FDA criou condições para que os medicamentos possam entrar no mercado com uma menor exigência nos dados de segurança e eficácia, pondo em causa os processo e padrões de qualidade que serviam de modelo para outros países do mundo. Sobre o que vai acontecer na Europa, ainda é cedo para avaliar, disse João Massano à rádio Observador. A Agência Europeia do Medicamento “pode interpretar [os dados] de uma forma diferente”, disse o neurologista.
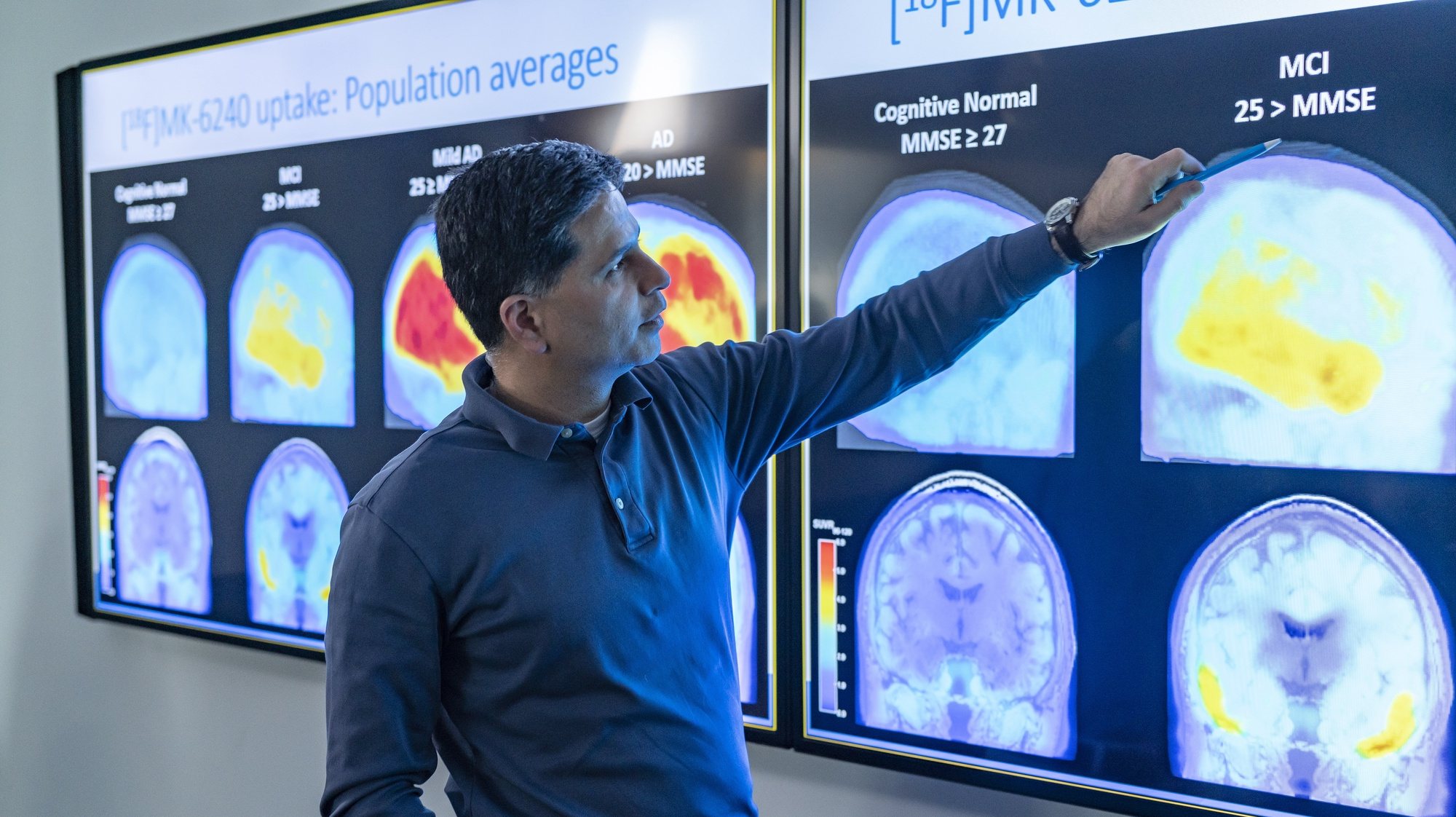
A autorização concedida a 7 de junho, coloca no mercado o primeiro medicamento que promete tratar o Alzheimer — até agora, todos os medicamentos tinham como objetivo reduzir os sintomas associados à doença. O aducanumab é um anticorpo monoclonal (fabricado em laboratório) que se liga às proteínas amiloides. O objetivo é que esta ligação funcione como uma sinalização para que o sistema imunitário possa destruir as placas amiloides (formadas pela acumulação das proteínas). Não é ainda uma cura, nem reverte as perdas cognitivas, mas poderia abrandar a progressão da doença.
A farmacêutica conseguiu mostrar que, em alguns casos, havia redução das placas, mas falhou na demonstração de que travava ou reduzia o declínio cognitivo — que deveria ser o alvo principal para demonstrar que a terapia funcionava. Durante muito tempo acreditou-se que as placas amiloides eram a causa do declínio cognitivo no Alzheimer, mas isso tem sido colocado em questão. Até ao momento, não foi possível demonstrar em nenhum ensaio clínico que a redução das placas amiloides traga benefícios cognitivos aos doentes com Alzheimer, disse Jason Karlawish, diretor do Penn Memory Center da Universidade da Pensilvânia (Estados Unidos), citado pela Nature News.
Cláudia Almeida confirma, mas acrescenta que as placas amiloides são, ao mesmo tempo, o indicador mais fácil de avaliar. No entanto, diz a investigadora do Centro de Estudos de Doenças Crónicas da Universidade Nova de Lisboa, remover as placas numa fase adiantada da doença pouco efeito tem porque “os neurónios já estão numa fase de morte programa irreversível”.
Mas foi precisamente esta redução na quantidade de proteína amiloide que levou a FDA a aprovar o medicamento, porque “é provavelmente razoável prever um benefício clínico para os doentes”. Ora, a redução na quantidade de proteína em alternativa a uma avaliação real da melhoria cognitiva, agora usada como argumento pela FDA, foi totalmente descartada por um membro da agência na reunião de especialistas em novembro, o que fez com que o painel nem sequer analisasse essa hipótese.
A Nature News destacou ainda que todos os fármacos dirigidos à redução das placas amiloides falharam na melhoria das condições cognitivas. É por isso que os cientistas citados pela revista receiam que se deixe de investir em alternativas e se passe a investir neste tipo de produtos — sem provas dadas — só porque terão alguma probabilidade de serem aceites pelo regulador. Pior, que uma empresa possa simplesmente mudar o tipo de candidatura na FDA para conseguir ver o medicamento aprovado, como alertou um dos conselheiros, citado pelo STAT News.
Os ensaios clínicos também não inspiraram confiança nem a Jason Karlawish, que trabalha há vários anos na área da demência e Alzheimer, nem ao comité independente que analisou os dados ainda incompletos e por publicar. Um dos ensaios clínicos de fase 3 não mostrou qualquer benefício em termos cognitivos e o outro também parecia não mostrar benefícios, até que a empresa escolheu voltar a analisar apenas uma parte dos dados e os anunciou como “um estudo robusto e excecionalmente convincente”.
“Isso abre a porta para as empresas farmacêuticas que buscam usar o programa de aprovação acelerada como uma forma de colocar os medicamentos no mercado com base em evidências de qualidade extremamente baixa ou pesca de dados post-hoc”, Aaron Kesselheim, que estuda Farmacoeconomia na Escola Média de Harvard (Boston) e é membro do painel que analisou o medicamento, citado pela Nature News.
Para agravar a situação, a FDA decidiu autorizar o medicamento, sem restrições, a todos os doentes com Alzheimer, apesar de nos ensaios clínicos só terem sido incluídas pessoas com um declínio cognitivo moderado. Os médicos estão preocupados com a hipótese das famílias comecem a pedir tratamentos para os doentes em fases mais avançadas da doença — fora do grupo de doentes que os médicos acreditam poderem ser tratados — e as companhias de seguros podem restringir o pagamento do tratamento a certas situações.
“Esta medicação é para o doente certo. E o doente certo, na nossa cabeça, é alguém que está na fase inicial da doença”, disse o neurologista Babak Tousi da Clínica Cleveland, que investiu nos ensaios clínicos do aducanumab e foi consultor da Biogen, citado pelo STAT News.
Cláudia Almeida concorda que os doentes têm de ser tratados logo na fase inicial da doença, para ainda ser possível ver alguns resultados. Para isso, destaca a investigadora, é preciso afinar os biomarcadores, melhorar os métodos de diagnóstico e, sobretudo, melhorar os ensaios clínicos. “Existem erros de recrutamento por erros no diagnóstico dos doentes”, diz.
Cientistas tentam encontrar raízes genéticas da doença Alzheimer nos portugueses
Relação custo-eficácia: “Não devíamos pagar nada”
Como seria de esperar, uma vez anunciada a aprovação do medicamento pela FDA, as ações da empresa farmacêutica dispararam e subiram 38%. Mas os ganhos da empresa vão aumentar ainda mais assim que esteja efetivamente em uso. A Biogen prevê que um ano de infusões mensais intravenosas possa custar 56 mil dólares (cerca de 46 mil euros), fora todos os custos associados à vigilância dos doentes. Contas feitas, mesmo que apenas 5% dos seis milhões de doentes com Alzheimer nos Estados Unidos recebessem o tratamento, isso já significaria uma receita de 17 mil milhões de dólares por ano, reportou a Nature News.
A este valor é preciso juntar outros custos associados, nomeadamente com exames de diagnóstico e monitorização, como as ressonâncias magnéticas, que podem chegar aos 30 mil dólares no primeiro ano de tratamento. E isto sem falar em todo o transtorno causado ao doente que tem de receber o tratamento na circulação sanguínea, durante uma hora todos os meses, e todos as análises e exames que terá de fazer para garantir que não tem efeitos secundários graves.
E quem pagaria as contas? As seguradoras de saúde norte-americanas poderão pagar o custo do tratamento, mas dificilmente vão suportar os restantes custos associados. Além disso, podem decidir pagar o tratamento apenas às pessoas que reúnam as condições estudadas nos ensaios clínicos (sintomas moderados e níveis aumentados da proteína amiloide) e não todas aquelas contempladas pela FDA, noticiou o jornal The New York Times. Ainda assim, isto pode significar um aumento dos prémios de seguro que vão acabar por prejudicar precisamente as famílias que já têm de lidar com os custos avultados de tratar de um doente com Alzheimer.
O custo do tratamento, tendo em conta todas as dúvidas em torno da sua eficácia, está desta forma bastante inflacionado. O Instituto de Revisão Clínica e Económica, que avalia o preço dos medicamentos, disse que para uma boa relação custo-benefício o preço do tratamento deveria variar entre 2.500 e 8.300 dólares por ano (cerca de 2.000 a 6.800 euros).
“Na verdade, não devíamos pagar nada. Devíamos continuar a investigar até que tenhamos medicamentos que se mostrem eficazes”, defendeu Peter Bach, especialista na atribuição de preço aos medicamentos no Memorial Sloan Kettering Cancer Center. “Não é nada convincente que devemos usar o medicamento de todo.”
Não bastasse o custo elevado do medicamento e a falta certezas quanto à eficácia, o tratamento está ainda associado a efeitos secundários graves: 40% dos doentes que participaram nos ensaios clínicos do aducanumab desenvolveram sangramento ou inchaço no cérebro. “O que estamos a pedir é que as pessoas arrisquem por um benefício desconhecido, mas um risco conhecido”, disse Jason Karlawish, citado pelo The New York Times.
Os novos estudos podem só estar completos daqui a nove anos
A pressão das associações de doentes e familiares e de outros grupos defensores do medicamento pode ter pesado na decisão da FDA. Uma das associações que agora se congratula com a decisão é a Associação Alzheimer, de Chicago, que no ano passado recebeu um donativo generoso da Biogen, revelou a Undark.
A Organização Mundial de Saúde estima que existam cerca de 50 milhões de pessoas com demência, das quais 60 a 70% serão doentes com Alzheimer, e que todos os anos mais de 10 milhões de pessoas venham a desenvolver demência. Conhecendo a importância do medicamento a nível mundial, a Biogen já pediu a revisão do medicamento aos reguladores da Austrália, Brasil, Canadá, Japão, Suíça e União Europeia.
“O desespero deve impulsionar o financiamento da investigação em Alzheimer, não deve conduzir a interpretação de evidências científicas”, disse Jason Karlawish à CNBC. O médico que tem dedicado a carreira ao estudo e tratamento do Alzheimer defende que este fármaco precisava de mais estudos antes de ser aprovado. A FDA, por sua vez, garantiu à CNBC que foi feita uma análise completa dos dados da empresa que eram “muito complexos”.
Na ausência de alternativas que permitam tratar os doentes com Alzheimer, Cláudia Almeida mantém uma postura otimista: “É verdade que os efeitos benéficos não são claros, mas acredito que possa ajudar algumas pessoas”.
A Sociedade Americana de Geriatria duvida e questiona os dados numa carta endereçada à FDA, lembrando que os dados dos ensaios clínicos estão incompletos uma vez que os testes foram interrompidos quando ainda estavam a meio (exatamente por não estarem a demonstrar resultados positivos), que não se deve aprovar um medicamento com base num ensaio incompleto, que os dados não podem ser selecionados depois de recolhidos para ver os que mostram aquilo que dá mais jeito e que os resultados ainda não foram publicados numa revista científica com revisão por outras cientistas da mesma área.
Quanto aos dados incompletos e pouco robustos, a FDA apresentou uma solução: a empresa tem de completar um novo ensaio clínico onde comprove a eficácia do medicamento na melhoria do estado cognitivo dos doentes. Mas a empresa já anunciou que tem nove anos para o fazer. Durante este tempo, a empresa pode continuar a vender o produto e pode até chegar ao fim do período (e do ensaio clínico) sem qualquer prova de que o fármaco funciona.