Dizem-nos os médicos, cientistas e investigadores que, no futuro, haverá cada vez mais casos de cancro. E a verdade é que aquilo que todos gostaríamos que não passasse de um exagero infundado é largamente confirmado pelas projeções da Organização Mundial da Saúde (OMS): de 19,3 milhões de novos casos de cancro diagnosticados em 2020, a OMS estima que se passe para 30,2 milhões em 2040. O salto é grande para um período de 20 anos, sim; mas é sobretudo terrível se a estes números juntarmos rostos e nomes. A grande esperança reside, pois, no desenvolvimento de terapêuticas capazes de curar, tratar e melhorar a qualidade de vida dos doentes oncológicos, como forma de minimizar o impacto desta doença. É precisamente neste desígnio que se inscrevem as inovadoras terapias celulares, nomeadamente a terapia celular CAR-T, que a partir das células do próprio doente vai, de forma personalizada e muito direcionada, reforçar o sistema imunitário contra o tumor.
Mas sobre como esta terapia funciona falaremos mais adiante, com a ajuda do cientista Bruno Silva-Santos, que lidera um grupo de investigação nesta área no Instituto de Medicina Molecular (IMM), e do hematologista José Mário Mariz, do Instituto Português de Oncologia (IPO) do Porto, que recorre a esta inovadora terapêutica para tratar doentes específicos, os quais, de outra forma, não teriam grandes hipóteses de sobrevivência. Para já, e para melhor compreendermos a terapia celular, é importante olharmos para aquela que é considerada a mais pequena porção de matéria em que pode manifestar-se vida: a célula.
Origem da vida — e do cancro
A palavra célula tem origem no latim cella, que significa quarto pequeno. O responsável pelo batismo foi Robert Hooke, que, em 1665, foi o primeiro a identificar estas unidades, comparando as células da cortiça, observadas através de um rústico microscópio, às pequenas divisões onde os monges viviam. Desde o século XVII até aos dias de hoje, muito se veio a descobrir, sabendo-se, atualmente, que o corpo humano adulto é composto por cerca de 100 biliões de células de 200 tipos diferentes, nomeadamente, as células sanguíneas, musculares, dérmicas, glandulares, nervosas (os neurónios) ou imunitárias (como os linfócitos), entre muitos outros. A agregação de células dá origem aos tecidos, e estes, por seu turno, constituem os órgãos do corpo humano, os quais cooperam entre si de forma a executarem funções complexas e específicas, formando os sistemas.
No início, o corpo humano começa por ser uma única célula, na forma de óvulo recém-fertilizado, sendo que, no seu ciclo de vida normal, as células envelhecem, morrem e são substituídas por novas células. Mas se é na célula que reside a origem da vida, também é aqui que, por vezes, se observam desequilíbrios que a põem em risco. Com efeito, um cancro não é mais do que uma doença que resulta do crescimento anormal e descontrolado de células que apresentam uma anomalia no seu ADN. Se se tratar de uma célula saudável, esta é capaz de corrigir uma possível alteração do seu ADN, evitando a proliferação da anomalia, mas as células cancerígenas não conseguem fazê-lo, logo, não morrem, continuando a crescer e a multiplicar-se, permitindo o crescimento e expansão do tumor.
Tratar o cancro com células
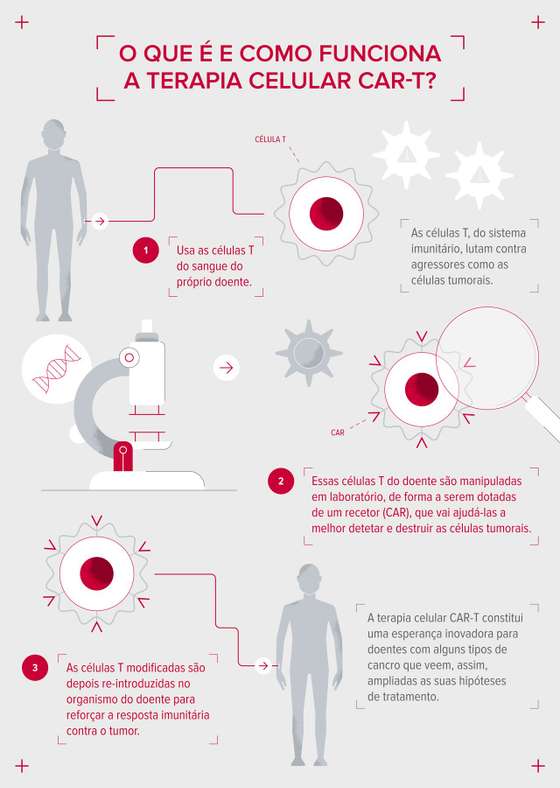
Partindo da unidade, é, pois, nas células que reside a base de uma das terapias contra o cancro mais inovadoras de que dispomos atualmente: a terapia celular. Segundo o cientista Bruno Silva-Santos, que coordena uma equipa dedicada a esta linha de investigação em imuno-oncologia no IMM, “as terapias celulares usam células como o ingrediente terapêutico”. Mais concretamente, em causa estão as células T, também designadas por linfócitos T, que integram o sistema imunitário e têm como tarefa a destruição de todo o tipo de moléculas que ameaçam o organismo.
“As células são a base da vida, pelo que se trata de um tratamento vivo, ao contrário de um comprimido, de quimioterapia ou de radiação”, explica o investigador, especificando que em causa estão “células imunitárias dirigidas, neste caso, ao tumor, com a capacidade de o eliminar, dada a sua propriedade de citotoxicidade”. E isto, porque estas células são manipuladas de forma a incluir “moléculas que matam células”.
Para se chegar a este resultado, “foram necessárias décadas de conceção e testagem de várias formulações e tipos de células imunitárias, desde os chamados TILs [tumor-infiltrating lymphocytes], retirados de biópsias de tumores sólidos, até às CAR-T [chimeric antigen receptor ou recetor de antigénio quimérico dos linfócitos T], aprovadas em 2017 para o tratamento de leucemia linfoblástica aguda”, refere Bruno Silva-Santos.
Embora o desenho inicial das CAR-T já tenha mais de três décadas, a sua aplicação clínica só foi possível na década passada, já que muitos estudos e ensaios tiveram de ser realizados até que esta terapêutica pudesse chegar aos doentes com total segurança.
Células CAR-T, o que é isto?
Antes de passar à explicação do cientista sobre o que é exatamente a terapia celular CAR-T e como funciona, importa perceber que as células humanas são envolvidas por uma membrana superficial — a membrana celular —, que, além de servir de invólucro a todo o seu conteúdo, tem a particularidade de integrar recetores na superfície, os quais permitem à célula identificar outras células. Além disso, estes recetores reagem à presença de substâncias produzidas no organismo ou outras, como os medicamentos, permitindo à célula selecionar o que nela entra ou sai. Ora, este mecanismo está também envolvido na terapia celular, já que, de acordo com Bruno Silva-Santos, as “CAR-T são células T modificadas geneticamente para expressar um CAR [chimeric antigen receptor], que é um recetor artificial, produzido por engenharia genética”. Ou seja, os linfócitos T do doente são manipulados em laboratório, de forma a serem dotados de um recetor artificial, que aumentará a sua capacidade de identificar as células tumorais.
A partir do momento em que estes recetores encontrem as células tumorais, as células CAR-T ficam ativas, libertando várias enzimas que levarão à destruição da célula tumoral. [Para saber mais sobre a terapia celular CAR-T consulte o nosso Explicador e oiça o episódio do podcast Células de Esperança, com o cientista Bruno Silva-Santos sobre o tema].
Uma nova esperança para alguns
Por se tratar de uma terapia muito específica, apenas alguns tipos de cancro e somente alguns doentes são considerados elegíveis para a receber. Segundo José Mário Mariz, diretor do Serviço de Onco-Hematologia do IPO do Porto, a terapia celular CAR-T pode ser equacionada em “doentes com diagnóstico de linfoma não Hodgkin difuso de grandes células B ou linfoma primário do mediastino, que tenham sido resistentes ou que tenham apresentado recidiva a pelo menos duas linhas de quimioterapia, ou após terem realizado autotransplante de medula óssea”. Nas suas palavras, o caminho de esperança aberto por esta terapia inovadora é imenso, uma vez que “estes doentes sem tratamento com CAR-T não terão grandes hipóteses de cura com as outras alternativas”; aliás, “a maioria não sobreviverá além dos dois anos”, afirma.
“O tratamento com células CAR-T melhora de forma significativa este panorama, já que é de esperar que cerca de 39% dos doentes tratados com esta tecnologia estejam livres da doença 2 anos após o tratamento, o que poderá corresponder a uma cura da doença”, sublinha o especialista. [Sobre os desafios enfrentados pelos doentes com linfoma, oiça o episódio do podcast Células de Esperança, com Manuel Abecassis, presidente da Associação Portuguesa Contra a Leucemia].
Desde o momento em que alguém é selecionado para a terapia CAR-T até que começa a ser tratado, é necessário esperar algum tempo. Isto porque em causa está um tratamento personalizado, logo, “tem de ser produzido individualmente para cada doente, pelo que é necessário algum tempo para a produção”, refere o hematologista, segundo o qual, “em regra, entre a primeira consulta e o tratamento, é necessário esperar cerca de seis semanas”. Ao contrário de outras terapêuticas oncológicas, esta com células CAR-T consiste apenas numa única administração.
Gestão do tratamento na prática clínica
José Mário Mariz realça que “o tratamento com células CAR-T é seguro”, ainda que sejam expectáveis alguns efeitos secundários, os quais “felizmente, na maioria dos casos, são transitórios”. Tal acontece porque depois da manipulação dos linfócitos T em laboratório, procede-se à infusão das CAR-T no doente, e haverá o contacto destas com as células tumorais, altura em que haverá ativação das CAR-T, o que levará à produção de várias citocinas”, esclarece o médico. Tempestade de citocinas ou síndrome de libertação de citocinas são as designações habituais para este fenómeno, sendo que as citocinas são as substâncias produzidas pelas células do sistema imunitário com o objetivo de ativar, mediar ou regular a resposta imunológica total do organismo. “Estas citocinas são responsáveis pelos efeitos secundários que podem ser muitos e variáveis”, indica o clínico, apontando como mais frequentes a febre, dificuldade em respirar, diminuição da tensão arterial, arritmias, infeções e inflamação do sistema nervoso central, o que pode provocar confusão mental, dificuldade em falar ou crises convulsivas. Tendo em conta os efeitos secundários esperados, o “tratamento é realizado em internamento, que dura cerca de duas semanas”.
De acordo com José Mário Mariz, “esta terapia está disponível em Portugal desde maio de 2019, e todos os doentes que tenham indicação para este tratamento poderão ter acesso, após referenciação do médico assistente, a um centro onde esta terapêutica esteja disponível”.
Aliás, segundo referiu Sérgio Chacim, hematologista no IPO do Porto, no podcast Células de Esperança, “Portugal foi dos primeiros países da Europa a tentar introduzir esta tecnologia e conseguiu”, importa agora refletir sobre novos modelos de financiamento mais adequados a estas tecnologias inovadoras cujo futuro está ainda a ser desbravado.
O futuro passa pelas terapias celulares
O caminho inaugurado pelas terapias celulares é promissor, mas muito há ainda a fazer. Bruno Silva-Santos identifica como grande objetivo da investigação atual o “desenvolvimento de terapias celulares para cancros não oriundos de células B, para os quais as condições de segurança são mais complexas”. Isto porque, como realça, “não podemos destruir tecidos saudáveis além do tumor localizado num órgão, como o intestino ou a próstata, por exemplo”. Para contornar esta dificuldade, o grupo de investigação que coordena no IMM usa outro tipo de células T — as DOT (Delta One T cells) —, encontrando-se esta pesquisa atualmente na fase inicial de ensaios clínicos na leucemia mieloide aguda. O intuito é poder usá-las também no tratamento de tumores sólidos. Todavia, “só com mais investigação poderemos atestar o seu potencial real nesses tipos de cancro”, reforça o investigador.
Além da aplicação a outros tipos de cancro, a investigação realizada atualmente visa também o desenvolvimento de terapias celulares alogénicas ou universais, isto é, que usem sangue de pessoas saudáveis para produzir a terapia celular. “Até agora, nomeadamente no caso das células CAR-T, a terapia é autóloga, ou seja, é produzida a partir de células do sangue do doente”, esclarece o cientista, segundo o qual, “isto é uma limitação grande, não só em termos de tempo, mas também na capacidade de aplicação a mais doentes”. “Com uma terapia alogénica, ter-se-iam bancos de células prontos a tratar muitos doentes diferentes. Mas para isso, é preciso que haja segurança na administração de células T entre pessoas diferentes”, sustenta. Como tal ainda não é possível, “há que selecionar células que não causam reações inflamatórias graves, como é o caso das DOT cells, entre outras plataformas celulares atualmente em desenvolvimento”, afirma o investigador que diz esperar que “o futuro traga boas novidades neste campo, para benefício de cada vez mais doentes”.
Este conteúdo está integrado no projeto
Células de Esperança