Às vezes saber que um medicamento funciona no tratamento de determinada doença é pouco. Perceber como é que isso acontece pode ajudar os investigadores a encontrarem novas terapias para aquela ou para outras doenças. Foi por isso que a equipa de Benjamin Ebert, investigador no hospital de Boston (Estados Unidos) – Brigham and Women’s Hospital -, decidiu estudar de que forma a lenalidomida atua no tratamento da Síndrome Mielodisplásica. Mas vamos lá explicar o que isto é.
A Síndrome Mielodisplásica é uma doença que afeta a medula óssea, mas cuja origem pode ser muito variada e a forma como se manifesta também pode diferir de doente para doente. Regra geral, nos doentes com mielodisplasias, as células da medula óssea – células hematopoiéticas – que deviam dar origem às células do sangue não se conseguem diferenciar-se convenientemente. Assim, há problemas na formação de glóbulos vermelhos (que transportam o oxigénio), glóbulos brancos (que participam na resposta imunitária) e/ou plaquetas (que participam na coagulação do sangue). Além disso, as células hematopoiéticas doentes podem multiplicar-se descontroladamente e vir a formar um tumor (leucemia).
No caso do estudo publicado na Nature esta quarta-feira, a doença é causada por um problema no cromossoma 5 – falta-lhe uma parte de um dos braços mais longos. Os investigadores verificaram que a parte em falta no cromossoma teria uma das cópias dos genes responsáveis pelas instruções para o fabrico da proteína CK1α e que o fármaco lenalidomida vai atuar sobre a degradação desta proteína.
Interessante é também o facto de a lenalidomida ser “altamente específica”, atuando apenas sobre uma proteína e só quando esta tem uma determinada concentração na célula, referiu Cláudia Grou, investigadora no grupo de Biogénese e Função de Organelos no Instituto de Biologia Molecular e Celular da Universidade do Porto, convidada pelo Observador a comentar este estudo.
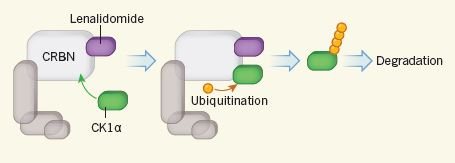
O processo pelo qual o fármaco (a roxo) consegue levar à degradação da proteína alvo (a verde) – Ito&Handa (2015) Nature_News&Views
Quando uma célula já está envelhecida ou quando não consegue cumprir a missão que lhe foi destinada deve morrer. Para isso existe dentro de cada célula um mecanismo de auto-destruição. Mas quando este mecanismo falha as células velhas e doentes podem acumular-se ou até continuar a multiplicar-se descontroladamente. Este processo pode levar, por exemplo, à formação de um tumor.
Ora, as células que têm um cromossoma 5 deficiente também não conseguem autodestruir-se. O mecanismo é complexo e depende de uma cadeia de reações em que umas proteínas inibem, estimulam ou degradam as outras. Simplificando, é a proteína CK1α que falámos anteriormente que inibe a p53 – uma proteína que pode levar à autodestruição das células.
Como referido, a lenalidomida vai ajudar outras proteínas a degradar a CK1α, nomeadamente a CRBN. Mas como? Imagine que a CRBN é um polícia sem algemas. Por muito que tente não consegue prender a CK1α. A lenalidomida funciona como as algemas que a CRBN precisa. Uma vez presa, a CK1α é “julgada e condenada à morte” – e marcada com ubiquitina (bolas amarelas na figura), uma proteína que aqui vai ter, neste caso, um papel “sinalizador”. Eliminando toda a CK1α, a p53 é livre de destruir a célula doente.
Este mecanismo está de tal forma bem montado que só acontece quando há pouca CK1α na célula, ou seja, quando a ausência de um braço no cromossoma 5 faz com que a célula tenha problemas em cumprir a função que lhe é destinada. Quando a produção de CK1α é normal, o polícia (CRBN) nem sequer aceitas as algemas (lenalidomida) para prender a proteína CK1α.
A taladomida, um fármaco da família da lenalidomida, também funciona como algemas para o polícia CRBN ajudando a prender uma molécula (neste caso diferente) que será marcada pela ubiquitina para degradação. No caso da taladomida, os estudos estão a ser feitos sobre o potencial para combater mieloma, uma forma de cancro que afeta os plasmócitos (glóbulos brancos que produzem anticorpos).
Este estudo foi realizado em linhas celulares humanas (células cultivadas numa caixa de petri) e em ratos de laboratório, mas nos ratos a lenalidomida não tinha qualquer efeito. Os investigadores verificaram que a CRBN nos ratos era ligeiramente diferente – a zona de encaixe do fármaco tinha um aminoácido diferente (uma das peças que compõe a proteína). Um aminoácido diferente numa proteína pode ser o suficiente para a estrutura a três dimensões ser completamente diferente e a função também. Estudar a estrutura tridimensional das proteínas mostra-se assim um passo importante da investigação.
Depois de toda esta informação ajudamo-lo a reter os seguintes pontos:
- o fármaco testado – lenalidomida – induz a morte das células que têm o cromossoma 5 com a falta de um braço;
- a lenalidomida não é eficaz em ratos de laboratório, mas sim em células de humanos;
- o fármaco só é eficaz quando a quantidade de CK1α é baixa;
- fármacos da mesma família têm modos de atuação semelhantes.














