A substância tirzepatide foi oficialmente aprovada pela agência norte-americana do medicamento (FDA, Food and Drug Administration) para o tratamento da obesidade, noticia o jornal The Washington Post. Esta molécula já era usada no tratamento da diabetes tipo 2 e o uso do mesmo para combater o excesso de peso tem levado a ruturas de stock.
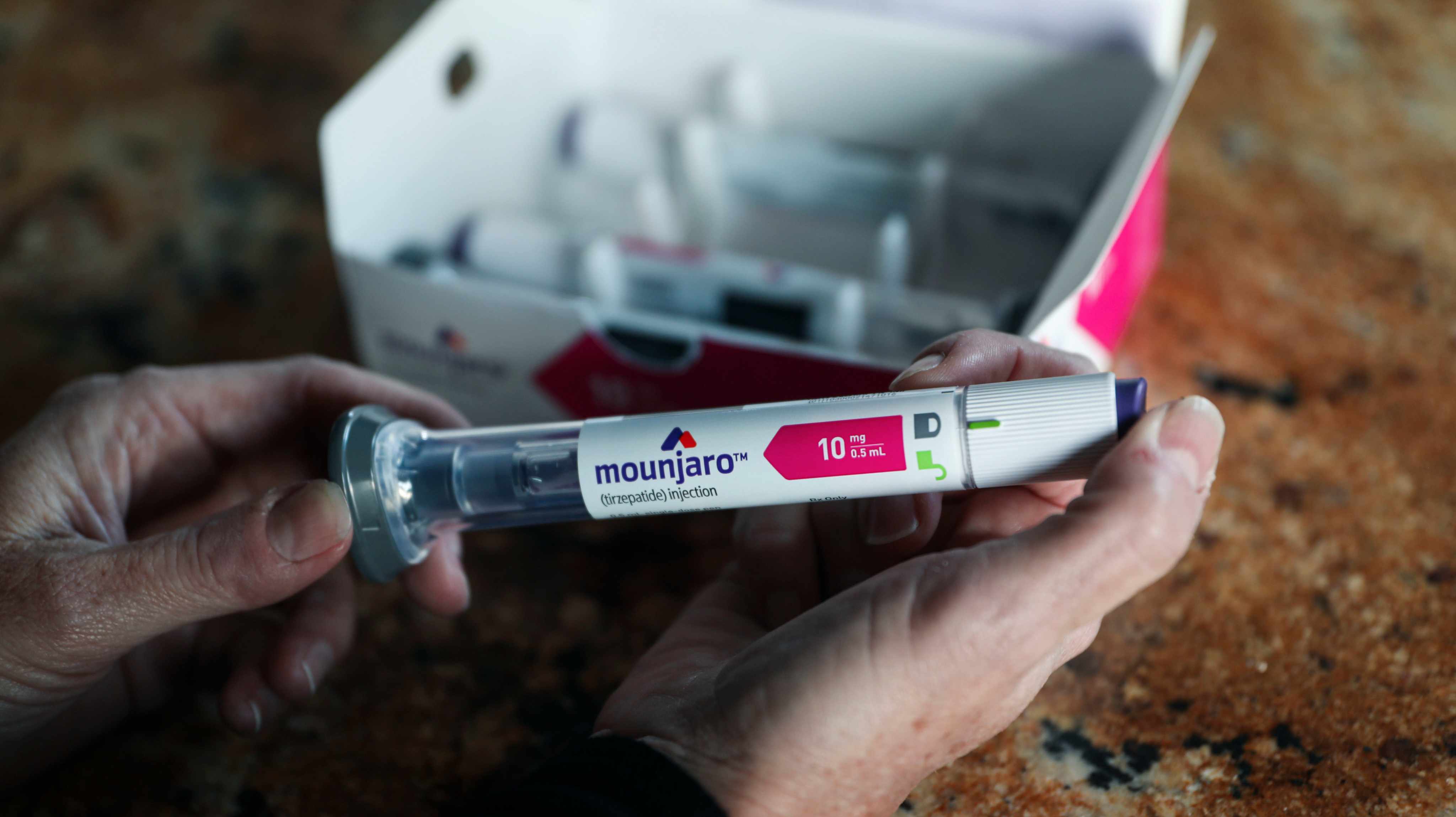
A molécula foi inicialmente aprovada sob o nome comercial de Mounjaro, em 2022, para o tratamento de diabetes tipo 2, primeiro pela FDA e depois pela Agência Europeia do Medicamento (EMA). Agora, foi aprovada com o nome comercial Zepbound, pela FDA, para o tratamento da obesidade. Ambos os medicamentos pertencem à empresa farmacêutica Eli Lilly.
Este medicamento induz a produção de insulina pelo pâncreas, o que leva à diminuição dos níveis de açúcar no sangue dos doentes com diabetes tipo 2. Adicionalmente, também reduz o apetite. Os doentes tratados com este medicamento mostraram ter perdido peso e melhorado os níveis de outros parâmetros clínicos, como pressão arterial, quantidade de gordura no sangue e em torno dos órgãos, refere o site da EMA.
Emagrecimento. Agências do medicamento alertam sobre compras online e sem receita
Estas vantagens adicionais, nomeadamente na perda de peso, faziam com que o medicamento fosse usado “off-label”, ou seja, fora do âmbito em que foi aprovada a sua comercialização, mas mediante consentimento médico. Este uso “off-label” levou a ruturas de stock em medicamentos para a diabetes tipo 2, como Mounjaro e Ozempic — e a denúncias de falsificação deste último.
Zepbound e Mounjaro têm muitas semelhanças, além da substância ativa: apresentam-se sob a forma de caneta injetável, para toma semanal, que deve ser aumentada gradualmente até um máximo a definir pelo médico (nunca acima dos 15 miligramas). Em ambos os casos, devem ser administradas em conjunto com um plano de exercício físico e uma dieta adequada.
A grande diferença é que o uso para a perda de peso nos casos de obesidade — cerca de 70% da população americana — deixam de ser feitos com uma formulação “off-label”. Com um medicamento “oficial”, os doentes podem pedir a comparticipação às seguradoras.
Especificamente para a perda de peso, espera-se que o medicamento reduza o apetite e, consequentemente, a ingestão de comida. A perda de peso nos ensaios clínicos foi de mais de 10% do peso inicial do doente.
Mais de metade da população mundial com excesso de peso ou obesidade em 2035, diz estudo
Zepbound está recomendado para adultos obesos (com índice de massa corporal de 30 quilogramas por metro quadrado ou superior) ou com excesso de peso (com índice de massa corporal de 27 quilogramas por metro quadrado ou superior) que tenham, pelo menos, uma condição clínica associada: pressão arterial elevada, diabetes tipo 2 ou colesterol elevado.
Como outros medicamentos, Zepbound pode ter efeitos secundários, normalmente relacionados com a digestão: naúseas e vómitos, diarreira ou obstipação, dores de estômago ou refluxo, pancreatite, cálculos biliares, e ainda hipoglicémia e retinopatia diabética, entre outros. Mas os alertas são sobretudo sobre para quem o medicamento é desaconselhado: pessoas com historial familiar para determinados tipos de cancro; pessoas propensas a doenças gastrointestinais graves ou pancreatite; e alérgicos a tirzepatide.