À primeira vista, o centro das atenções deste projeto não parece ter nada de especial: um copo de vidro grande cheio com água turva. Mas a realidade microscópica revela-se bem mais interessante: milhares de cápsulas com pequenos tumores tridimensionais em desenvolvimento. Analisar o desenvolvimento destes tumores microscópicos poderá trazer mais informações sobre o crescimento das células malignas e ajudar a encontrar medicamentos mais eficazes para as combater.
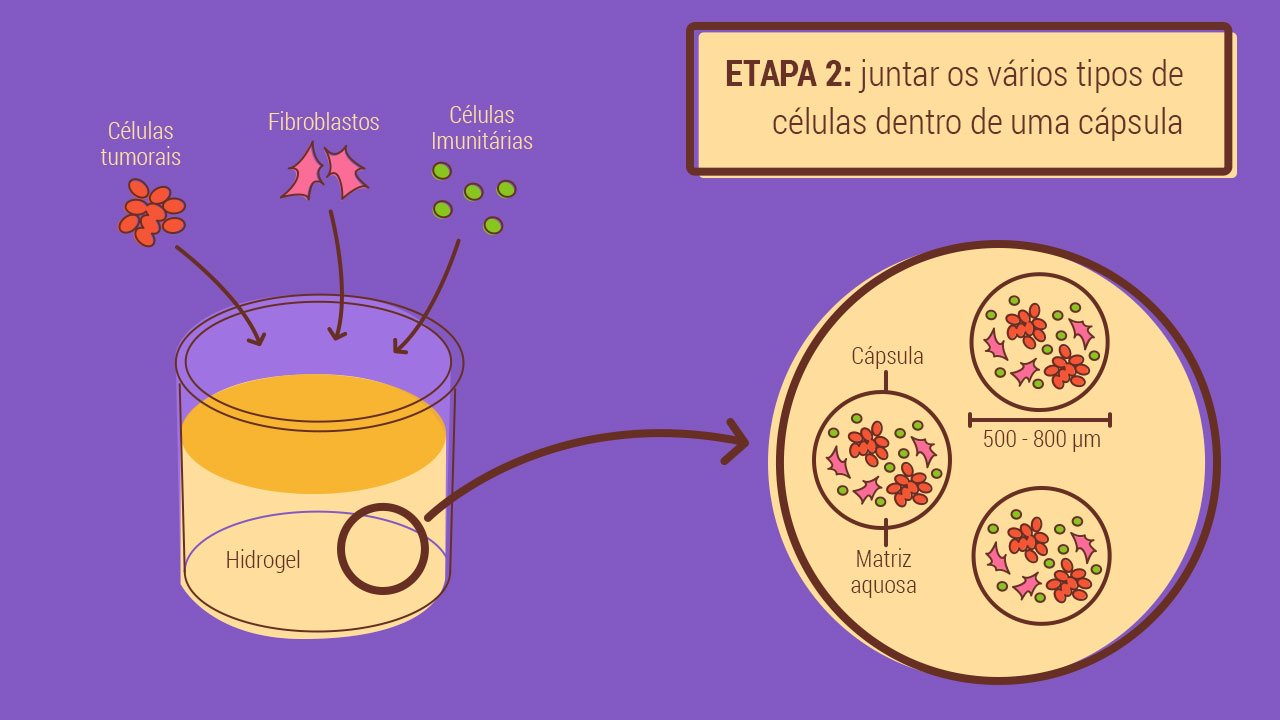
Cada uma destas cápsulas é, na verdade, uma experiência isolada, mas replicada milhares de vezes num único recipiente, que faz com que todos os sistemas sejam sujeitos às mesmas condições. As pequenas esferas, de exterior rijo e interior aquoso, servem de suporte às células tumorais em desenvolvimento. Já a “água turva”, e o sistema em que está montada, permitem uma oxigenação e alimentação permanente das células, numa tentativa de imitar o que acontece num organismo.
O grande copo cheio de cápsulas – biorreator – pode manter os tumores em desenvolvimento durante dois ou três meses, permitindo aos investigadores “roubar” algumas esferas para análise e acompanhar o processo com o mínimo de intervenção possível. No final esperam poder perceber como evoluem as células tumorais, que moléculas produzem, que influência têm os outros componentes colocados dentro das cápsulas e criar classificações mais precisas para os tipos de tumor que têm à sua frente.
Para que queremos modelos de cancro tridimensionais?
“Um em cada três portugueses nascidos no século XXI terá cancro e muitos morrerão por sua causa”, escreve o patologista Manuel Sobrinho Simões, no livro “O Cancro”, da Fundação Francisco Manuel dos Santos. Assim, é fácil perceber por que motivo a investigação nesta área cresceu tanto nos últimos anos.
Mas falar de uma cura para o cancro é quase uma falácia, porque o cancro não é uma doença, mas várias. Cada órgão poderá ter um tipo de cancro diferente e dentro de cada órgão poderão existir subtipos distintos. Sem falar que cada tumor tem origem nas células da própria pessoa, portanto, em última análise, cada cancro é único. Ainda assim, existem tratamentos mais ou menos generalistas que podem ser aplicados a muitos doentes e muitos outros, ainda em estudo, prometem ser ainda mais eficazes.
O problema, aponta Catarina Brito, investigadora no Instituto de Biologia Experimental e Tecnológica (IBET), é que a taxa de insucesso de novos fármacos é muito grande. “Apenas cinco a 10% das moléculas que entram nos ensaios clínicos [com humanos] saem para o mercado.” Falham na segurança ou na eficácia, quando os ensaios pré-clínicos (com modelos celulares ou animais) pareciam tão promissores. É preciso melhorar a avaliação nesta fase pré-clínica e é isso que a equipa do Laboratório de Modelos Celulares Avançados, coordenado por Catarina Brito, se propõe fazer. “Se os modelos conseguirem fazer uma melhor decisão pré-clínica [se um fármaco deve avançar nos ensaios ou não] vai haver uma redução de custos muito grande.”
E que melhor maneira de perceber se um fármaco atua num tumor do que testá-lo nas próprias células tumorais? Melhor, só mesmo conseguir replicar o próprio tumor em laboratório como se se tivesse a desenvolver dentro do organismo humano. Com tanto ainda por fazer nesta área, a equipa do IBET tem uma proposta: criar modelos tridimensionais tumorais com base numa técnica que já desenvolveram para a criação de modelos tridimensionais com células de fígado, do coração e do sistema nervoso central.
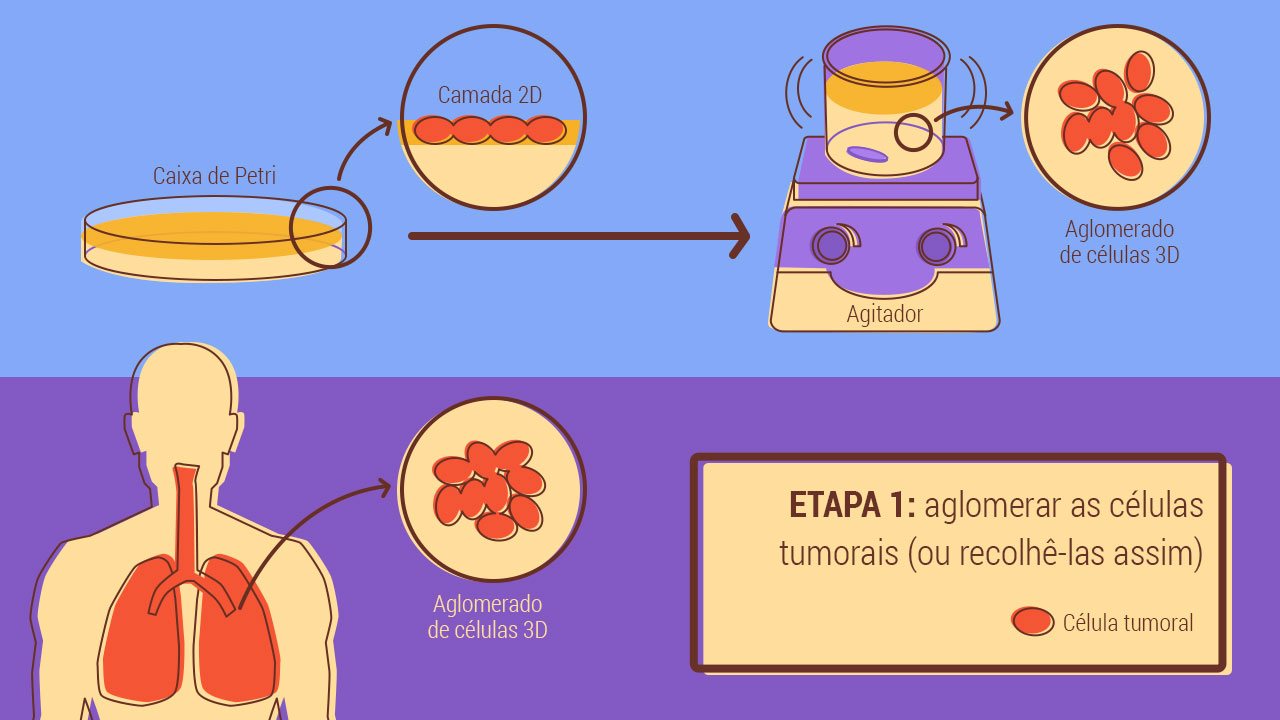
O primeiro passo é conseguir organizar as células em três dimensões como acontece num tecido. Isto pode ser conseguido partindo das linhas celulares laboratoriais – que foram adaptadas para crescer em monocamada e que agora têm de aprender a aglomerar-se novamente – ou com amostras de tumores de doentes, como as que o laboratório consegue da parceria que tem com o Instituto Português de Oncologia de Lisboa. A vantagem da utilização das primeiras é que estão bem caracterizadas e isso permitiu validar o modelo que a equipa está a criar.
Agora, a equipa quer usar as células tumorais dos doentes para cumprir outro objetivo: encontrar pontos comuns nos tumores dos doentes para identificar subgrupos dentro dos subtipos tumorais conhecidos. “Queremos identificar os fatores extra-tumorais que vão condicionar a resposta do tumor à terapia”, acrescenta Catarina Brito. “Neste projeto não nos focamos na célula tumoral em si, mas no que está no microambiente [que a envolve], porque este microambiente é reflexo do que a célula tumoral está a fazer.”
↓ Mostrar
↑ Esconder
Os fibroblastos são células do tecido conjuntivo, envolvidas na produção de colagénio e de fatores de crescimento. O ambiente tumoral pode alterar a atividade dos fibroblastos, colocando-os “ao serviço” do tumor.
Sabendo que um tumor é muito mais do que as células malignas que o compõe, é preciso combinar os aglomerados tumorais com os fibroblastos ou com as células imunitárias que ficam aprisionadas nestes sistemas tumorais. Este conjunto de células produz um leque de moléculas próprio que contribui para a comunicação entre elas e para a evolução e amadurecimento do tumor. Um dos objetivos do grupo de investigação de Catarina Brito é, com base nas culturas com células tumorais dos doentes do IPO, conseguir caracterizar este ambiente que dá estrutura ao tumor, que serve como via de comunicação entre as células e que lhes apresenta o alimento de que necessitam para se continuarem a reproduzir.
Este ambiente, a matriz extra-celular onde se desenvolvem as células, é, deste conjunto, o que está menos estudado e o que se torna mais difícil de reproduzir. Também por isso alguns modelos anteriores de tumores tridimensionais falharam. Esta gelatina semissólida, que mantém as células todas juntas, funciona como um cimento que mantém os tijolos num muro, com a vantagem de ser mais flexível e de ter mais funções do que exclusivamente a fixação.
A equipa do Advance Imaging Lab, do Instituto Gulbenkian de Ciência, criou uma ferramenta microscópica que permitiu à equipa do IBET verificar que as cápsulas [esferas translúcidas] tinham do seu interior as células tumorais [aglomerados maiores] e fibroblastos [células mais pequenas]. Na segunda parte do vídeo, cápsulas com células tumorais [a vermelho] e fibroblastos [a verde].
Até agora, a estratégia de outros grupos de investigação tem sido, sobretudo, aproveitar o “cimento” que se forma nos tumores induzidos nos ratos de laboratório, mas é muito difícil conseguir ter sempre o mesmo tipo de “cimento” – e essa seria a única maneira de tornar as experiências comparáveis entre si. Depois há todos o tipo de matrizes criadas para o efeito, desde aquelas que têm um ou poucos componentes – mas que, por isso mesmo, são incompletas na sua representação –, àquelas que tentam da forma mais completa possível reproduzir todos os componentes – mas a metodologia é tão cara e complexa que se torna muito difícil de implementar de forma rotineira.
A estratégia do IBET foi diferente: dão ao conjunto de células heterogéneas um material aquoso inerte, ou seja, que não tem qualquer atividade biológica, mas que lhes serve de suporte – como uma estante de livros onde as células se podem ir arrumando. E cabe ao próprio conjunto de células produzir os componentes de que necessitam – a chamada matriz extracelular ou “cimento”, como aqui lhe chamámos. Até porque o tipo de componentes presente nessa matriz extracelular vai variar à medida que o tumor for evoluindo, como verificaram os investigadores, nos pequenos “assaltos” aos biorreatores para analisar o conteúdo de algumas cápsulas.
↓ Mostrar
↑ Esconder
As linhas celulares, criadas em laboratório, têm as células todas iguais (homogéneas). Nas amostras de tumor retiradas dos pacientes, os conjuntos são heterogéneos porque existem várias tipos de células.
Este material aquoso inerte, que se vai “transformar” numa cápsula cheia de água com as células lá dentro, também pode ser usado com células homogéneas, mas o que acontece é que, passe o tempo que passar, a matriz será sempre igual. As células homogéneas, de um determinado estádio de desenvolvimento do tumor, não conseguem evoluir para outra fase, porque lhes faltam as células não-tumorais que normalmente se encontram nos organismos vivos e que influenciam o crescimento do tumor.
Os modelos heterogéneos e os biorreatores permitem manter as culturas celulares durante muito mais tempo. Desta forma, é possível testar os fármacos por um período mais longo de tempo ou testá-lo várias vezes para perceber melhor os mecanismos de resistência tumoral. “Há muitos fármacos que são eficazes numa primeira abordagem, mas muitos tumores desenvolvem resistência a esses fármacos”, sublinha Catarina Brito.
E antes destes modelos, como se fazia?
Mesmo sem os modelos tridimensionais para o cancro, a investigação em novos fármacos para tratar a doença avança, mas sempre com uma exigência: tem de passar com distinção nos ensaios pré-clínicos, aqueles que se fazem antes de os fármacos serem dados pela primeira vez a humanos. Nesta fase, os fármacos são, no mínimo, testados em linhas celulares e em animais. Mas são as comprovadas limitações destes ensaios que levam a que novos sistemas ou sistemas complementares sejam criados.
“Os modelos são modelos. Ou seja, não recapitulam tudo e não conseguem prever tudo”, lembra Catarina Brito. “Em função da pergunta que temos, é preciso perceber se um determinado modelo consegue responder ou não a essa pergunta de forma fidedigna.” A investigadora acrescenta ainda que não existem modelos perfeitos, por isso cada um deles poderá ser necessário numa fase diferente. E dá o exemplo dos ensaios em animais, porque são a única maneira de reproduzir o que acontece a um determinado fármaco ou molécula num organismo vivo. E, à luz dos conhecimentos atuais, nenhum fármaco vai para ensaios clínicos sem ter demonstrado que é seguro em modelos animais.
O projeto europeu Predect, em que a equipa do IBET participou, pretendia criar linhas orientadoras sobre os melhores modelos a utilizar para cancro da mama, próstata e pulmão, mas a diversidade mostrou-se tão grande, tendo cada modelo as suas especificidades próprias, que o projeto acabou por ser mais uma caracterização do estado da arte, explica Catarina Brito. Nos cinco anos de projeto, não se chegou a nenhuma conclusão sobre o melhor modelo a usar, porque não existe nenhum que assim possa ser designado, mas as linhas orientadoras pretendem chamar a atenção para as limitações de cada modelo e os fatores que devem ser tidos em consideração na utilização de cada um. “Há cada vez mais pessoas a usar modelos tridimensionais, mas ainda um bocado com a mentalidade com que usavam os modelos tradicionais. Nesse sentido, existem algumas orientações para alertar para esses aspetos”, refere a investigadora.

Os modelos mais simples serão, certamente, os modelos celulares que crescem numa camada única de células (monocamada). As células utilizadas foram em tempos recolhidas de um tumor, mas foram posteriormente adaptadas à cultura em laboratório. As vantagens da utilização deste tipo de células é que estão muito bem caracterizadas e são muito fáceis de replicar em laboratório – portanto nunca há falta de matéria-prima bem conhecida. A grande desvantagem é tratar-se de um conjunto de células homogéneo quando cada vez se tem mais a certeza que o tumor é um sistema complexo de células diferentes umas das outras. Além disso, um modelo bidimensional não é fiel a reproduzir um sistema que na realidade é tridimensional.
A cultura destas linhas celulares, que crescem em caixas de petri ou em pequenos poços, tem ainda outra desvantagem quando comparada com os modelos tridimensionais propostos pela equipa de Catarina Brito. As células são alimentadas esporadicamente com maiores concentrações do alimento que necessitam, enquanto nos biorreatores do IBET o alimento e o oxigénio estão continuamente a circular numa relação mais próxima do que acontece num organismo vivo. O resultado é que as linhas celulares têm de ser renovadas ou mudadas de sítio a cada três a cinco dias, enquanto os modelos do biorreator podem aguentar dois ou três meses. Em termos práticos, é mais tempo para estudar o desenvolvimento de um determinado tumor ou os efeitos que um fármaco tem na cultura celular.
“Um humano num chip”
↓ Mostrar
↑ Esconder
Os microchips são plataformas com pequenos canais por onde se fazem passar os fluídos – que podem ter alimento ou fármacos – e câmaras onde se encontram o modelo de órgão que se pretende estudar.
As câmaras podem representar, sequencialmente, órgãos diferentes ou conjuntos de células diferentes, como células do fígado numa para ver como processam o fármaco e um tumor na seguinte que vai receber o fármaco já metabolizado pelas células hepáticas.
A vantagem destes modelos, em relação aos modelos animais, é que usam células humanas.
Os modelos animais, como se viu, são praticamente obrigatórios e Catarina Brito acredita que ainda serão precisos muitos anos e uma grande evolução nos restantes modelos para que se possa abdicar da experimentação animal no que diz respeito à investigação em saúde humana. Nem mesmo os modelos em microchips conseguem competir com os modelos animais neste aspeto.
Na área do cancro pode trabalhar-se com dois tipos principais de modelos animais: os que são geneticamente modificados para que desenvolvam um tumor ou para que apresentem algumas características mais próximas dos humanos ou os que recebem um transplante do tumor. O problema principal é que, fisiologicamente, um rato, um cão, um macaco ou um humano serão sempre diferentes e as interações com os medicamentos também podem ser distintas. Depois, mesmo nos modelos geneticamente modificados, nem sempre é possível reproduzir fielmente a evolução do tumor como acontece nos humanos – logo, se não é igual, não é absolutamente comparável. Por fim, nos modelos que recebem transplantes, o sistema imunitário é “desligado” para o transplante não ser rejeitado e, como já foi demonstrado, as células do sistema imunitário têm um papel importante no desenvolvimento do tumor.
As linhas celulares em monocamada e os modelos animais apresentam vantagens e desvantagens, mas os modelos tridimensionais desenvolvidos pela equipa de Catarina Brito também não estão livres de limitações. No interior das cápsulas, os investigadores podem ter células imunitárias, aquelas que foram “aprisionadas” pelo tumor, mas não terão aquelas que estão em circulação no organismo. E mesmo que consigam adicionar essas células imunitárias periféricas recolhidas do sangue dos pacientes, nunca será exatamente o mesmo que ter o tumor a crescer num organismo vivo com sangue circulante.
Mesmo em relação às linhas celulares que existem em laboratório, os modelos baseados em amostras dos tumores dos pacientes têm uma desvantagem: têm muito menos células disponíveis para repetir as experiências.
Apesar das limitações, Catarina Brito reconhece as vantagens do modelo que criaram e lembra que um modelo é apenas um modelo e que, muitas vezes, se usam vários modelos para confirmar as conclusões obtidas com um deles. Mais, a investigadora reforça que, neste momento, a equipa está empenhada em validar o modelo, em mostrar que é fidedigno e que os resultados são reprodutíveis. “É um modelo diferente. Esperamos que seja mais recapitulativo, mais preditivo, mas é preciso validar isso numa primeira fase, perceber se o modelo está realmente mais próximo da realidade.”