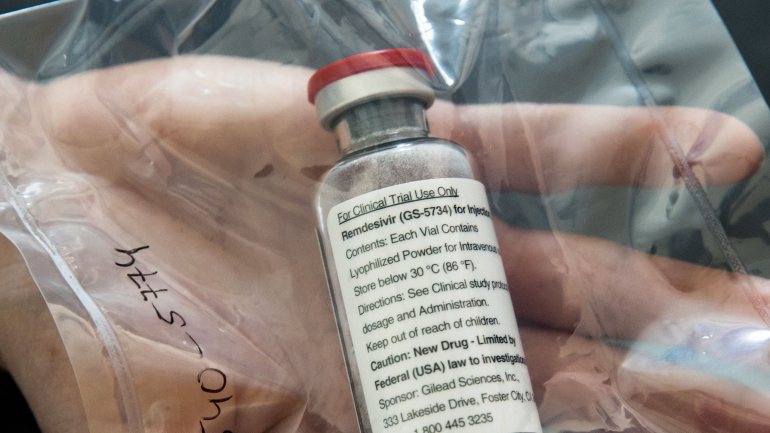
É um dos medicamentos mais promissores a ter sido testado em doentes com Covid-19 e, esta sexta-feira, o seu uso foi autorizado pela FDA, a agência norte-americana que regula os medicamentos. O antiviral continua a ser alvo de ensaios clínicos, embora os testes em humanos que serviram de base para a decisão da organização terem arrancado no dia 21 de fevereiro.
Com uma amostra de 1.063 pacientes, os que receberam remdesivir tiveram uma recuperação 31% mais rápida do que aqueles que receberam o placebo.
O anúncio foi feito pelo próprio presidente dos Estados Unidos, esta tarde. Ao autorizarem o uso do medicamento da Gilead, originalmente desenvolvido para tratar doentes com ébola, há cerca de uma década, os Estados Unidos permitem que seja usado em pacientes hospitalizados e comprovadamente infetados pelo novo coronavírus.
Contudo, Stephen Hahn, comissário da FDA, apressou-se a esclarecer que o medicamente apenas foi aprovado para uso em situações de emergência em pacientes, mais do que hospitalizados, em estado grave. Uma autorização para uso pleno seria bem mais morosa, pois envolveria uma análise bem mais longa da substância.
“A decisão de hoje é um passo importante na colaboração com investigadores para dar aos doentes o acesso a novas terapias, sempre que for apropriado, e de forma a continuar a avaliar melhor se são seguras e eficazes”, explicou Hahn. “Através do Programa de Aceleração do Tratamento ao Coronavírus, a FDA trabalha 24 horas por dia e com todas a ferramentas para acelerar esses esforços”, concluiu.
A eficácia do remdesivir não é totalmente consensual. Na última semana, ensaios clínicos levados a cabo por investigadores chineses não reuniram a melhor das apreciações finais, embora outros testes anteriores ao medicamente da farmacêutica norte-americana tivessem resultado em conclusões bem mais animadoras.