Pedro Matos Pereira nunca teve propriamente um plano. Nunca quis. Estar onde está, aos 39 anos, foi uma sucessão de acasos e não de intencionalidades.
Um exemplo: pouco antes de se candidatar à licenciatura em Química Aplicada na Faculdade de Ciências e Tecnologia da Universidade Nova de Lisboa (UNL), ainda achava que poderia querer ser advogado. Mas calhou falar com um amigo da mãe que o fez mudar de ideias. Outro: no fim da licenciatura foi fazer investigação para o Instituto de Tecnologia Química e Biológica António Xavier (ITQB), também da UNL, porque no verão, sem mais que fazer, resolveu acompanhar um amigo que se estava a candidatar a um estágio naquela instituição. Acabou por também ser entrevistado e foi ele que ficou.
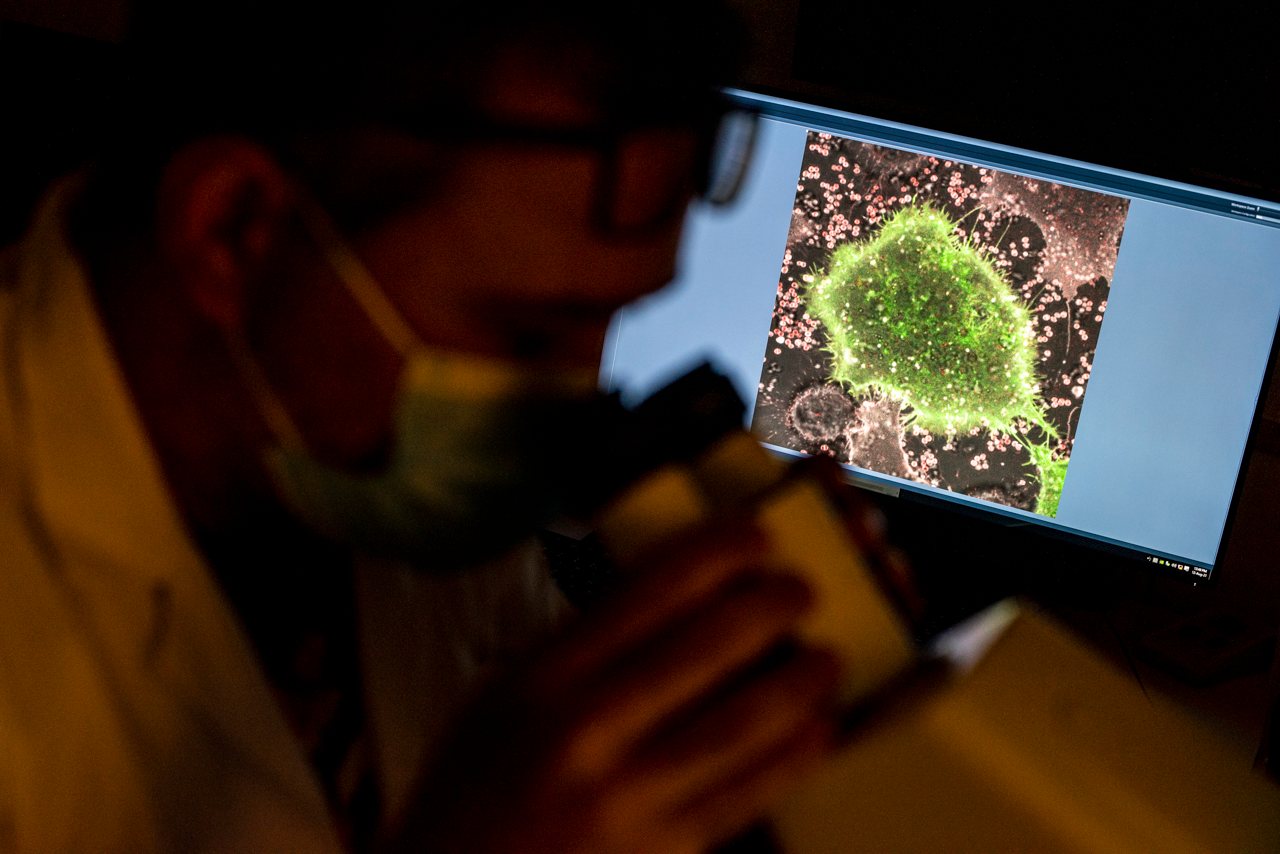
Partindo do estudo da Staphylococcus aureus, uma bactéria comum que cerca de 30% das pessoas tem no nariz, o investigador quer perceber porque é que, apesar de algumas serem perfeitamente inofensivas, outras são resistentes a antibióticos e capazes de matar pessoas saudáveis
“A minha vida é feita de acasos. Houve uma altura que tinha vergonha disso, porque há aquela ideia que um cientista a sério sempre foi alguém com um plano e tem uma história que explica por que é que se tornou cientista. Eu não tenho.”
Com ou sem um plano, o certo é que, nos últimos anos, o cientista doutorado em Biologia Celular – que durante cinco anos fez investigação no Medical Research Council Laboratory for Molecular Cell Biology da University College de Londres – fez descobertas importantes sobre os mecanismos de interação bactéria-hospedeiro, sobretudo relacionados com a forma como estes microrganismos se protegem do nosso sistema imunitário. E apesar de hoje, por razões óbvias, o mundo estar mais focado nos vírus, as projeções mostram que vamos ter problemas graves com as bactérias em breve.
Se não arranjarmos novas formas de tratamento, até 2050, as mortes causadas por bactérias com resistência a antibióticos vão ser superiores às do cancro e das doenças cardiovasculares, que são as duas maiores causas de morte neste momento”, diz o investigador. Esse é o tamanho gigante do desafio que enfrentamos.
A banal experiência de ter uma infeção urinária mostra que as análises realizadas, além de identificarem a bactéria responsável, testam sua sensibilidade e/ou resistência a vários antibióticos, para que o médico possa prescrever o mais eficaz a eliminá-la. Junto ao nome dos antibióticos vem a indicação “resistente”, sinalizando que aquela molécula não é uma opção. Isso é cada vez mais frequente. O aumento das resistências é explicado, em parte, por problemas há muito conhecidos: o uso indevido de antibióticos por conta própria, a prescrição de moléculas de largo espectro antes de saber qual é a bactéria em causa, o uso de antibióticos na pecuária que nos chegam através da alimentação e o pouco investimento da indústria farmacêutica no desenvolvimento de novas moléculas.
Mas há outra questão, de base, que explica o problema: a esmagadora maioria dos antibióticos que usamos são produzidos pelas próprias bactérias, como forma de lutarem umas contra as outras. “Elas fazem o mesmo que os humanos fazem nas guerras: competem por armas. Por isso, vivendo num ambiente competitivo, produzem antibióticos para se matarem umas às outras. Como têm de ter forma de não morrer com os antibióticos que criam para matar as bactérias concorrentes, desenvolvem mecanismos de resistência.”

Nos últimos anos, Pedro fez descobertas importantes sobre os mecanismos de interação bactéria-hospedeiro, sobretudo relacionados com a forma como estes microrganismos se protegem do nosso sistema imunitário
Como se isto não chegasse, compreendeu-se recentemente que as bactérias vivem em sítios inesperados para se esconderem do nosso sistema imunitário. E é neste aspeto que se foca o projeto de Pedro Matos Pereira, vencedor de uma bolsa de Pós-Doutoramento Junior Leader, da Fundação “la Caixa”. Partindo do estudo da Staphylococcus aureus (S. aureus) – “uma bactéria muito comum que cerca de 30% das pessoas têm no nariz” – Pedro quer perceber porque é que, apesar de algumas serem perfeitamente inofensivas, outras são resistentes a vários antibióticos e capazes de matar pessoas saudáveis.
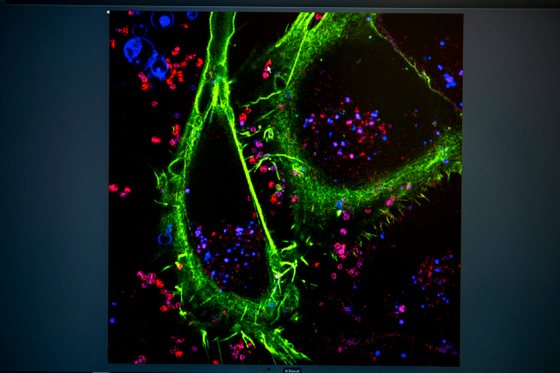
A diferença entre umas e outras pode estar na maneira como se conseguem esconder e sobreviver. Sabemos muito sobre o que as bactérias fazem dentro do nosso corpo, mas pouco sabemos sobre o que fazem dentro das nossas células. Há vários vídeos na Internet que mostram uma célula do nosso sistema imunitário a perseguir uma bactéria. Quando a “apanha”, “come-a” e acaba o vídeo. Acontece que a história não termina onde o vídeo acaba. “O que nós sabemos agora é que às vezes o macrófago come-a mas ela não morre, como esperado. Consegue sobreviver, divide-se, mata a célula e continua o seu caminho para ir infetar mais.”
Isto implica que as bactérias tenham uma série de capacidades diferentes para sobreviver: dentro da célula há menos espaço e menos recursos, pelo que tem de haver sistemas dedicados a suportar este estilo de vida. “Sabemos que entram nas células, não sabemos o que fazem lá dentro. Que mecanismo usam para não serem reconhecidas? Como se dividem? Como é que saem? E saem iguais ou diferentes?” Estas são as perguntas às quais o investigador quer responder. As respostas podem ajudar tanto a combater infeções recorrentes, como infeções resistentes aos antibióticos.

Para isso, Pedro Matos Pereira vai usar microscópios de super-resolução 3D de células vivas, para perceber em detalhe os mecanismos destas interações. “Não há melhor forma de ver uma coisa, do que vendo essa coisa”, garante. É essencial e muito útil a visão global, conseguida através da observação de grandes conjuntos de células, bactérias e genes, mas é na observação das singularidades que pode estar a diferença.
“Quando se quer perceber porque é que uma bactéria sobreviveu dentro de um macrófago – quando 90% delas não sobrevive – é preciso ir ao detalhe. Porque apesar de não ser o cenário dominante, são estas 10% que vão causar doença. Para isso, é preciso observar aquela célula e bactéria individualmente.”

A resistência das bactérias aos antibióticos deve-se, em parte, à automedicação, à prescrição de moléculas de largo espectro, aos antibióticos na pecuária que nos chegam através da alimentação e ao pouco investimento no desenvolvimento de novas moléculas. O cientista quer ajudar a inverter isso
A microscopia também lhe proporciona o que, para o investigador, é mais apaixonante na ciência: o privilégio de ver coisas absolutamente novas e, até aí, desconhecidas. “Não há nada mais lindo do que estar no microscópio e ver uma coisa que nunca ninguém antes viu. Ser a primeira pessoa no mundo inteiro, de sempre, que vê aquilo.”
Mas conseguir ver coisas novas, é mais do que um prazer pessoal: é um desígnio profissional. É fazer boa ciência. “A boa ciência é aquela que gera conhecimento. E não há mau conhecimento. Aquilo que hoje, aparentemente, não tem uma aplicação prática, pode curar alguém daqui a dez anos ou vinte anos”.
Este artigo faz parte de uma série sobre investigação científica de ponta e é uma parceria entre o Observador, a Fundação “la Caixa” e o BPI. O projeto de Pedro Matos Pereira no ITQB foi um dos 45 selecionados (nove de Portugal) – entre 575 candidaturas – para financiamento pela fundação sediada em Barcelona, ao abrigo da edição de 2020 do programa de bolsas de Pós-Doutoramento Junior Leader. O investigador recebeu trezentos mil euros por três anos. As bolsas Junior Leader apoiam a contratação de investigadores que pretendam continuar a carreira em Portugal ou Espanha nas áreas das ciências da saúde e da vida, da tecnologia, da física, da engenharia e da matemática. As candidaturas para a edição de 2022 deverão abrir em breve.