Uma publicação com uma imagem forte de apelo aos pais no processo de vacinação acompanha uma mensagem onde um utilizador do Facebook desafia os seus seguidores a consultarem o site da Agência Europeia de Medicamentos (EMA) para verem como “as vacinas da Pfizer estão em fase experimental até 2023”. É mesmo isto que diz a EMA?

A mensagem continua, com uma conclusão: “É um crime contra os portugueses, deixar e incentivar uma vacina que ainda está em fase experimental. Quem paga o valor emocional da perda das mortes destas pessoas a curto, médio e longo prazo…?”, questiona o mesmo utilizador. Mas vamos por partes, começando precisamente pelo site que é citado.
Nas informações disponibilizadas pela EMA sobre a vacina Comirnaty, comercializada pela Pfizer, estão respostas a várias perguntas e uma delas é sobre “que informação é ainda aguardada?”. Na resposta surge a indicação de que a vacina está sob uma “autorização de comercialização condicionada”, já que o “estudo principal vai prosseguir por dois anos”. A informação geral sobre esta vacina foi inicialmente introduzida na página oficial da EMA em dezembro de 2020 e atualizada em outubro. A referência “comercialização condicionada” consta desde que a Agência Europeia do Medicamento avaliou de forma positiva a segurança e eficácia da vacina em questão.
Mas o que quer dizer, afinal, “comercialização condicionada”? Quer dizer que a vacina não foi testada ou não é segura, como sugere a publicação em análise? E que é experimental? O Infarmed já explicou o que quer isto dizer, quando detalhou o processo geral de produção das vacinas contra a doença que está na origem da pandemia. Tendo em conta o contexto pandémico, o processo de investigação de vacinas contra Covid-19 foi acelerado, mas “as vacinas Covid-19 só serão aprovadas e disponibilizadas aos cidadãos se cumprirem todos os requisitos de qualidade, segurança e eficácia”, começa por detalhar a autoridade nacional do medicamento.
E acrescenta que, depois de salvaguardada a “relação benefício-risco positiva” da vacina, “a autorização de introdução no mercado, que será inicialmente condicional, irá basear-se em dados específicos suficientemente sólidos, que permitam avaliar a qualidade da formulação, a segurança dos doentes e eficácia da vacina na prevenção da doença, sendo permitido que os titulares de autorização de introdução no mercado possam complementar, posteriormente, os dados inicialmente apresentados às autoridades para robustecer a autorização”. É isto que, perante a EMA, a Pfizer se comprometeu a fazer durante dois anos, até 2023.
“Ainda que o procedimento de avaliação seja condicional e mais expedito, a avaliação realizada pelas autoridades garante os mesmos critérios de rigor e robustez científica, assegurando a qualidade, segurança e eficácia destas vacinas, tal como qualquer outro medicamento”, assegura o Infarmed.
Vamos por partes. No processo de investigação das vacinas contra a Covid-19 não foram ignoradas fases. O que aconteceu foi que já existiam estudos existentes sobre vírus da mesma família, o que permitiu acelerar as fases inicias de estudos pré-clínicos e, na fase dos ensaios clínicos, os tempos das três fases foram sobrepostos. Tendo em conta a urgência da pandemia declarada pela Organização Mundial de Saúde, também a avaliação regulamentar das autoridades do medicamento foram aceleradas para permitir a rápida distribuição das vacinas.
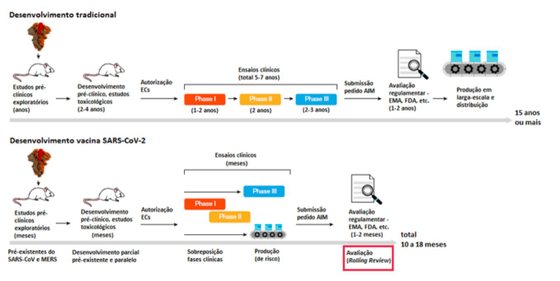
Excerto da explicação do Infarmed sobre o processo de produção de vacinas.
A fase atual em que está a vacina da Pfizer não é, assim, experimental. A “autorização condicional” diz respeito à entrada da vacina no mercado, “é o mecanismo regulamentar [da legislação comunitária] mais adequado para autorização de uma vacina na atual emergência de pandemia, sendo garante do acesso de todos os cidadãos da União Europeia a uma vacina com a mesma qualidade, segurança e eficácia que outras vacinas já autorizadas, permitindo ir ao encontro das campanhas de vacinação em massa. Também garante a avaliação completa dos dados disponíveis e estabelece obrigações claras ao titular da AIM [autorização de introdução no mercado] para salvaguardar a segurança, qualidade e eficácia”.
No site citado na publicação, quando fala nesta autorização condicional para a vacina da Pfizer ser comercializada, a EMA esclarece precisamente que a empresa “vai continuar a providenciar resultados do ensaio principal, que prossegue por mais dois anos. Este ensaio e outros estudos adicionais vão providenciar informações sobre a durabilidade da proteção, a eficácia da prevenção de Covid-19 severa, a eficácia na proteção de pessoas imunodeprimidas, mulheres grávidas e também sobre a prevenção de casos assintomáticos”.
Isto é, não há nada que indique que persistam dúvidas sobre a segurança da vacina ou que ela esteja, sequer, em fase experimental. “Isto significa que há mais evidências sobre a vacina que a empresa terá de fornecer. A Agência analisará todas as novas informações que venham a estar disponíveis e esta análise geral será atualizada conforme necessário”, garante.
Aliás, a EMA esclarece, na mesma nota informativa sobre a vacina da Pfizer, que existem também outros “estudos independentes de vacinas contra a Covid-19 coordenados pelas autoridades da União Europeia e que também fornecerão mais informações sobre a segurança e os benefícios da vacina a longo prazo para a população em geral”.
Sublinhe-se que a EMA também garante que esta vacina foi alvo de “um grande ensaio clínico que mostrou que a Comirnaty foi eficaz na prevenção de Covid-19 em pessoas a partir dos 12 anos de idade”. A análise feita pela Agência fez com que concluísse que a vacina “oferece um alto nível de proteção contra a Covid-19, cuja necessidade é crítica na atual pandemia”, e isto com base no tal “ensaio principal” que “mostra que a vacina tem 95% de eficácia”. Os estudos sobre a vacina e que dão conta disto mesmo foram publicados em dezembro de 2020 no “The New England Journal of Medicine”.
A EMA refere também que “a maioria dos efeitos secundários têm gravidade leve a moderada e desaparecem em poucos dias”. E conclui que foi perante os dados recolhidos que “decidiu que os benefícios da Comirnaty são maiores do que os riscos”.
Sobre alguns dos grupos em relação aos quais existe ainda “informação limitada” — caso das pessoas com sistemas imunitários mais frágeis —, a conclusão é a de que, “embora os imunodeprimidos possam não responder tão bem à vacina, não há preocupações de segurança concretas. Os imunodeprimidos podem ser vacinados, já que estão em maior risco” perante a Covid-19, aconselha a EMA.
Sobre as grávidas, outro dos grupos sobre o qual os dados existentes ainda são insuficientes para tirar conclusões, a EMA refere os “estudos em animais” que foram feitos e que “não revelam efeitos nocivos na gravidez”. E que a decisão sobre o seu uso nestas mulheres “deve ser feita em consulta com um profissional de saúde após considerar os benefícios e riscos”.
Conclusão
É falso que o site da Agência Europeia do Medicamente refira que a vacina da Pfizer está em fase experimental, como alega a publicação no Facebook que aqui analisamos. O que a EMA refere é que a vacina foi colocada no mercado com uma “autorização condicionada”. Esta autorização não tem nada a ver com a segurança da vacina.
Surge, sim, na sequência desta mesma garantia e para responder à emergência de saúde pública. Ou seja, primeiro, surge a comprovação científica da segurança e eficácia da vacina e, depois, para que possa ser rapidamente autorizada a sua introdução do mercado, é acionado este “mecanismo regulamentar da União Europeia” que permite à empresa que a produz “complementar, posteriormente, os dados inicialmente apresentados às autoridades para robustecer a autorização”.
O que é “condicional” — e não “experimental” — é a autorização europeia, que está obrigatoriamente associada a uma constante atualização do estudo principal da vacina até 2023.
Assim, de acordo com o sistema de classificação do Observador, este conteúdo é:
ERRADO
No sistema de classificação do Facebook este conteúdo é:
FALSO: as principais alegações do conteúdo são factualmente imprecisas. Geralmente, esta opção corresponde às classificações “falso” ou “maioritariamente falso” nos sites de verificadores de factos.
Nota: este conteúdo foi selecionado pelo Observador no âmbito de uma parceria de fact checking com o Facebook.

















